题目内容
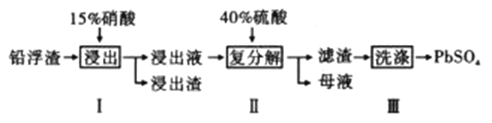
【题目】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb,还含有少量的Ag、CaO)制备硫酸铅。制备流程图如下
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式___________________________,为防止Ag被溶解进入溶液,步骤I操作时应注意_______________________。
(2)粗PbSO4产品含有的杂质是____________;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是_________________。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的SO42-过多,循环利用时可能出现的问题是______________________________。
(4)若将步骤Ⅱ中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为___________mol/L。
(5)(CH3COO)2Pb是皮毛行业可溶于水的染色助剂,可用PbSO4与CH3 COONH4反应制备,写出该反应的离子方程式_______________________。
(6)铅蓄电池是电压稳定、使用方便的二次电池。PbSO4在其中扮演了重要角色,写出铅蓄电池充电时阳极的电极反应_______________________。
【答案】 ![]() 控制硝酸的用量铅浮渣(或pb)稍有剩余(其他合理答案均给分:硝酸不足、浮渣过量、pb过量、pb稍有剩余) CaSO4 C 浸出部分pb2生成pbso4随浸出渣排出降低pbso4的产率 1.6×10.3
控制硝酸的用量铅浮渣(或pb)稍有剩余(其他合理答案均给分:硝酸不足、浮渣过量、pb过量、pb稍有剩余) CaSO4 C 浸出部分pb2生成pbso4随浸出渣排出降低pbso4的产率 1.6×10.3 ![]()
![]()
【解析】(1)铅与硝酸反应生成一氧化氮和硝酸铅,反应的方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,当铅过量时银不能溶解,所以为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余;(2)根据流程可知,粗PbSO4 产品含有的杂质是CaSO4,可以用Pb(NO3)2溶液洗涤除去,答案选C;(3)若母液中残留的 SO42-过多,在步骤I中就会有硫酸铅沉淀出现,会随浸出渣排出,故答案为:浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率;(4)若将步骤Ⅱ中的Pb2+完全沉淀,c(Pb2+)![]() 10-5mol/L,Ksp(PbSO4)= c(Pb2+) c(SO42-)=1.6×10-8,则溶液中的c(SO42-)至少为
10-5mol/L,Ksp(PbSO4)= c(Pb2+) c(SO42-)=1.6×10-8,则溶液中的c(SO42-)至少为![]() =1.6×10-3mol/L;(5)铅蓄电池放电时正极是氧化铅得电子生成硫酸铅,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O。
=1.6×10-3mol/L;(5)铅蓄电池放电时正极是氧化铅得电子生成硫酸铅,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O。