��Ŀ����
����Ŀ�����������仯��������Ҫ�Ͻ���Ϻʹ������䴢��Ͻ����Ϊһ������п���ӵ�صĸ������ϣ��õ����Zn(CF3SO3)2Ϊ����ʣ�����ȱ�ݵ���������ZnMn2O4Ϊ�缫���ɹ�������ȶ��Ĵ��ʵ�����
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ________�����Ų�ʱ������ߵ�����ռ���ܼ���ԭ�ӹ����________����չ����
��2��VO2+������������γ���������ͬ�����ҵ�һ�����ܱ����������Ԫ����____(дԪ�ط���)��
��3�����γɵ�������[Ni��NH3��6]2+��[Ni(CN)4]2-�У�NH3���ӵĿռ乹��Ϊ_______����CN-��Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ__________��
��4����������(CF3SO3H)��һ���л�ǿ�ᣬ�ṹʽ��ͼ1��ʾ��ͨ����CS2��IF3��H2O2��Ϊ��Ҫԭ������ȡ��
��H2O2������Oԭ�ӵ��ӻ���ʽΪ________��
��������������ⱽ��Ӧ�����������ᱽ���͵⻯�⡣1���������ᱽ�������к�����������ĿΪ__________��

��5����п����Ĺ����ж��֣�����һ����п�ľ�����ͼ2��ʾ���þ�����S2-����λ��Ϊ____��
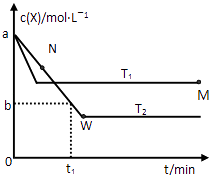
��6�������Ͻ�����Ҫ������ϣ��䴢���ľ�����ͼ3��ʾ��
�ٴ���ǰ�������Ͻ�Ļ�ѧʽΪ___________��
�ڸ������Ͻ�����������ܶ�Ϊ________(��NA��ʾ�����ӵ���������ֵ)g.cm-3��
���𰸡� [Ar]3d34s2 5 N��F ������ N2��CO sp3 19 4 LaNi5 ![]()
����������1����̬��ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d34s2��[Ar]3d34s2�����Ų�ʱ������ߵĵ�����ռ���ܼ�Ϊ3d��3dԭ�ӹ����5����չ������ȷ�𰸣�[Ar]3d34s2��5��
��2����ԭ���ڵڶ�����VIA�壬ͬһ���ڴ������ң�����ͬ�����ҵ�һ�����ܱ����������Ԫ���е�ԭ�ӡ���ԭ�ӣ���ȷ�𰸣�N��F��
��3�����������е�ԭ�Ӽ۵��Ӷ���ĿΪ3+1/2����5-1��3��=4�����Բ���sp3���ռ乹��Ϊ�����Σ���CN-��Ϊ�ȵ����壨������14����һ�ַ��ӵĻ�ѧʽΪN2��CO����ȷ�𰸣���������N2��CO��
��4����H2O2����H-O-O-H��Oԭ�ӳ�2���Ҽ�����2�Թ¶Ե��ӣ�ԭ���ӻ������=�ļ���+�¶Ե��Ӷ���=2+2=4��������sp3�ӻ�����ȷ�𰸣�sp3��
�ڸ��ݸ��л���Ľṹ������1�������к��ЦҼ���3�� C-F ����1��C-S ����2�� S=O ���� 1�� S-O����1��C-0���������Ϻ���5��C-H����6�� C-C ��������1���������ᱽ�������к��ЦҼ�����ĿΪ19����ȷ�𰸣�19��
��5�����ݾ����ṹͼ�������к���S2-��Zn2+����λ����ȣ���������Zn2+����Ҿ�����ȵ�S2-��4������λ��Ϊ4����ȷ�𰸣�4��
��6���ٸ��ݾ����ṹͼ������ǰ�������к�����ԭ����=8��1/8=1, ��ԭ����8��1/2+1=5���Ͻ�Ļ�ѧʽΪLaNi5����ȷ�𰸣�LaNi5��
�ھ���������������Ŀ8��1/4+2��1/2=3.�����ĺϽ�ѧʽΪLaNi5H6,�����1mol���������Ϊ��(a��10-10)3��NA= a3��10-30 ��NAcm3,1mol�����к��е���������Ϊ6g���������Ͻ������ܶ�Ϊ��6����a3��10-30 NA��g/cm3����ȷ�𰸣�6����a3��10-30 NA����

����Ŀ��������������һ������Ư������������Ư�ס�������Ч������H2O2�������ᡣij��ҵ�ù��������صIJ��ֲ������±���
����ʽ | ��� | �ȷֽ��¶� | �۵� | ˮ����(20��) |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | 500g��L-1 |
�ϳɹ��������صIJ��輰��Ӧ����ʾ��ͼ���£���250mL������ƿ�м���һ������30%��H2O2��Һ���ټ���30g���أ��ڲ��Ͻ�����������300�棬ʹ������ȫ�ܽ⣬����30min,��ȴ��-5����нᾧ�����˵ð�ɫ��ĩ״�ᾧ����50���¸���2h���ù��������ز�Ʒ���ش��������⣺
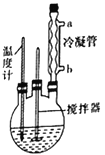
(1)���Ʒ�Ӧ�¶ȵ����˷�����__________ (�����)��
A���ƾ��Ƽ��� B���ƾ���Ƽ��� C����¯���� D��ˮԡ����
(2)��Ӧ���з�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(3)��Ӧ��������������ˮ��______(�a����b��)��������Ӧ�������¶Ȳ���̫�ߵ�ԭ����___________��
(4)����������ѡ�����ʻ����ʲ��ϵ�ԭ����_______________________________________��
(5)Ϊ�ⶨ��Ʒ�л������ĺ���(������16%���൱�ں�H2O234%)����ȡ������Ʒ12.000g���ܽ⣬��250mL ����ƿ�ж��ݡ�ȷ��ȡ25.00mL����ƿ�У�����1mL6mol��L-1�����ᣬȻ����0.2000mol��L-1KMnO4����Һ�ζ�(KMnO4��Һ�����ز���Ӧ)��ƽ��ʵ�����Σ�ʵ�������£�
ʵ����� | 1 | 2 | 3 | |
KMnO4��Һ���/mL | �ζ�ǰ���� | 0.00 | 0.00 | 2.00 |
������ | 19.98 | 21.70 | 22.02 | |
��KMnO4��ҺӦʢ����__________�ζ����У��ζ��յ��������_____________��
�ڲ�Ʒ�л���������������Ϊ____________��
�����ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ��������ݣ���ʹ��õĻ���������__________(�ƫ�ߡ���ƫ�͡����䡱)��