题目内容
14.下列分子中所有原子都满足最外层8电子稳定结构的是( )| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 二氧化碳(CO2) | D. | 三氟化硼(BF3) |
分析 XeF6、HClO、CO2、BF3均为共价化合物,分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构.
解答 解:A.XeF6中,Xe原子的原子核外最外层电子数为8,其在分子中的化合价为+6价,在分子中的原子最外层电子数为14,故A不符合;
B.HClO属于共价化合物,H原子最外层只有1个电子,其化合价为+1,则H在分子中的原子最外层电子数为2,故B不符合;
C.CO2为共价化合物,分子中C、O原子均满足原子最外层电子数+该元素原子化合价绝对值=8,两种原子均达到了8个电子稳定结构,故C符合;
D.BF3为共价化合物,B原子的原子核外最外层电子数为3,其在分子中的化合价为+3价,在分子中的原子最外层电子数为6,故D不符合,
故选C.
点评 题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.有关物质的分类,下列说法正确的是( )
| A. | CH3CH(CH3)2属于链状化合物 | B. | 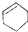 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 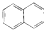 属于脂环化合物 属于脂环化合物 | D. | 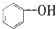 属于芳香烃 属于芳香烃 |
2.下列各种说法正确的是( )
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引力
④冰的密度比水的密度小,这与氢键有关
⑤根据电离方程式HCl═H++Cl-,推断HCl分子里存在离子键.
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引力
④冰的密度比水的密度小,这与氢键有关
⑤根据电离方程式HCl═H++Cl-,推断HCl分子里存在离子键.
| A. | ①⑤ | B. | 都不正确 | C. | ④ | D. | ⑤ |
19.烃分子中若含有双键,叁键或单键的环,氢原子数就少,分子就不饱和,即具有一定的“不饱和度”,其数值可表示为:不饱和度(Ω)=双键数+环数+叁键数×2,则有机物 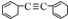 的不饱和度为( )
的不饱和度为( )
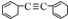 的不饱和度为( )
的不饱和度为( )| A. | 8 | B. | 7 | C. | 6 | D. | 10 |
6.下列各组离子在指定溶液中能大量共存的是( )
| A. | 室温下,pH=1的溶液中:Na+、NH4+、NO3-、CO32- | |
| B. | 使酚酞呈红色的溶液中:Na+、K+、SiO32-、AlO2- | |
| C. | 含有大量SO32-的溶液中:K+、Ca2+、ClO-、NO3- | |
| D. | 加入Al能放出H2的溶液中:Mg2+、NH4+、HCO3-、Cl- |
3.以下化学用语正确的是( )
| A. | 乙醇的分子式CH3CH2OH | B. | CH3COCH3的官能团名称:醚键 | ||
| C. | 苯的最简式:CH | D. | 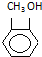 的类别:醇类 的类别:醇类 |

 ;
; (填结构简式).
(填结构简式). 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).