题目内容
6.下列各组离子在指定溶液中能大量共存的是( )| A. | 室温下,pH=1的溶液中:Na+、NH4+、NO3-、CO32- | |
| B. | 使酚酞呈红色的溶液中:Na+、K+、SiO32-、AlO2- | |
| C. | 含有大量SO32-的溶液中:K+、Ca2+、ClO-、NO3- | |
| D. | 加入Al能放出H2的溶液中:Mg2+、NH4+、HCO3-、Cl- |
分析 A.pH=1的溶液为酸性溶液,碳酸根离子与酸性溶液中的氢离子反应;
B.使酚酞呈红色的溶液中中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.次氯酸根离子能够氧化亚硫酸根离子,钙离子与亚硫酸根离子反应生成亚硫酸钙;
D.加入铝放出氢气的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,镁离子、铵根离子和碳酸氢根离子能够与氢氧根离子反应,碳酸氢根离子还能够与氢离子反应.
解答 解:A.该溶液为酸性溶液,溶液中存在大量氢离子,CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.使酚酞呈红色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、K+、SiO32-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.SO32-与Ca2+、ClO-之间发生反应,在溶液中不能大量共存,故C错误;
D.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,Mg2+、NH4+、HCO3-与氢氧根离子反应,HCO3-与氢离子反应,在溶液中一定不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
19.下表为元素周期表前4周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
| X | ||
| Y | Z | R |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | Z的氧化物与X单质在任何条件下都不会发生置换反应 | |
| D. | R的最外层电子数一定为5 |
17.某元素的一种核素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX分子中含质子的物质的量是( ) mol.
| A. | $\frac{a}{A+m}$(A-N+m) | B. | $\frac{a}{A}$(A-N) | C. | $\frac{a}{A+m}$(A-N) | D. | $\frac{a}{A}$(A-N+m) |
14.下列分子中所有原子都满足最外层8电子稳定结构的是( )
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 二氧化碳(CO2) | D. | 三氟化硼(BF3) |
1.某化合物的结构式 (键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
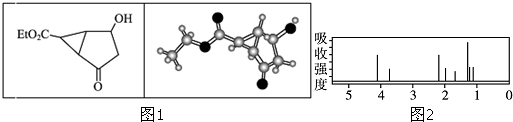

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
18.下列反应的离子方程式正确的是( )
| A. | 钠与水的反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe++Cu=Fe2++Cu2+ | |
| D. | 氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O |
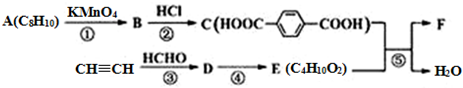
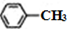 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$
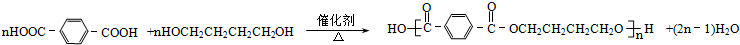 .
.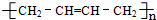
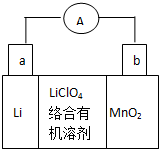 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,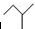 表示2-甲基丁烷,则
表示2-甲基丁烷,则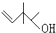 所表示的有机物的分子式为C7H14O,该物质的官能团有碳碳双键和羟基.
所表示的有机物的分子式为C7H14O,该物质的官能团有碳碳双键和羟基.