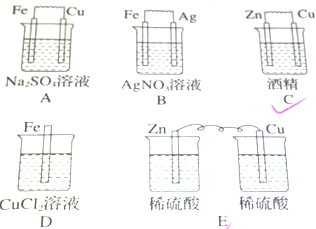
题目内容
1. 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).(1)氮元素在周期表中的位置是第二周期VA族;
(2)写出实验室制取氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)如何检验烧瓶中的氨气是否已经集满?(操作、现象、结论)将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明氨气已收集满.
(4)用如图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水;该实验的原理是氨极易溶解于水,致使烧瓶内气体压强迅速减小.
(5)假设该喷泉实验在标准状况下进行,且喷泉结束后溶液充满了整个烧瓶(溶质没有扩散到烧瓶以外),则烧瓶中所得溶液的物质的量浓度是$\frac{1}{22.4}$mol•L-1.
分析 (1)N元素的原子序数为7,核外电子总数为7、核外含有2个电子层、最外层含有5个电子层;
(2)根据实验室制取氨气的原理,利用盐和碱的复分解反应确定方程式;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验;
(4)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(5)氨气溶于水,溶液体积等于氨气体积,设氨气的体积为VL,则溶液的体积为VL,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:(1)N元素的核电荷数为7,最外层为5个电子,氮元素在周期表中的位置为第二周期VA族,
故答案为:第二周期VA族;
(2)氯化铵和氢氧化钙发生复分解反应,生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,可以用湿润的红色石蕊试纸靠近烧瓶口,如果试纸变蓝,则氨气已满,
故答案为:将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明氨气已收集满;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,操作方法为:打开止水夹,挤出胶头滴管中的水,
故答案为:打开止水夹,挤出胶头滴管中的水;氨极易溶解于水,致使烧瓶内气体压强迅速减小;
(5)氨气溶于水,溶液体积等于氨气体积,设氨气的体积为VL,则溶液的体积为VL,标况下VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,故所得溶液的物质的量浓度为:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
故答案为:$\frac{1}{22.4}$.
点评 本题考查了氨气的制备和性质、物质的量浓度的计算,题目难度中等,注意掌握氨气的实验室制法及反应原理,明确形成喷泉的原理和操作方法是解答的关键.

| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 二氧化碳(CO2) | D. | 三氟化硼(BF3) |
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、I-、Cl-、SO42- | ||
| C. | NO3-、Fe3+、Cl-、I- | D. | NO3-、Cl-、Na+、SO32- |
| A. | 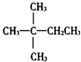 | B. | CH3CH2CH2CH2CH3 | C. | 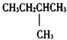 | D. |  |
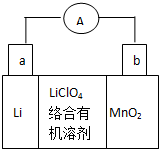 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中, CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动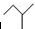 表示2-甲基丁烷,则
表示2-甲基丁烷,则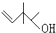 所表示的有机物的分子式为C7H14O,该物质的官能团有碳碳双键和羟基.
所表示的有机物的分子式为C7H14O,该物质的官能团有碳碳双键和羟基.