题目内容
【题目】乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJg-1,则△H3=___kJmol-1
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___,![]() =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
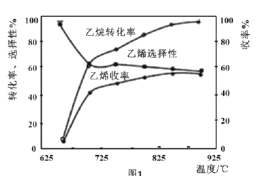
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
【答案】< -2615.8 B 0.025 molL1min1 0.75 温度升高,反应速率加快,转化率升高 C 正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动
【解析】
⑴反应III是体积减小的反应。
⑵先根据乙烯的热值为50.4kJ·g1,求出△H2,再根据盖斯定律计算△H3。
⑶①该反应是放热反应,降低温度,速率降低;②建立三步走进行计算。
⑷①由图可知,随温度的升高,乙烷的转化率再升高,考虑化学反应速率的影响因素;根据图中要使乙烷的转化率尽可能高,而副产物又相对较少,及乙烯的选择性较高。
②正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,利于平衡正向移动。
⑴反应III是体积减小的反应,因此△S < 0;故答案为:<。
⑵已知乙烯的热值为50.4kJ·g1,则△H2=-1411.2 kJ·mol1将第II个方程式的2倍减去第I个方程式得到III,则△H3=-2615.8·mol1;故答案为:-2615.8·mol1。
⑶①该反应是放热反应,反应达到平衡后,仅降低温度,速率降低,k正、k逆匀减小,平衡向放热方向即正向进行,正反应速率大于逆反应速率,因此k正减小的倍数更少;故答案为:B。
②
![]() ,x=0.25mol,则0~10min内
,x=0.25mol,则0~10min内![]() ,k逆c2(
,k逆c2(![]() )=k正c2(CH2=CH2)c(O2),
)=k正c2(CH2=CH2)c(O2), ;故答案为:0.025 molL1min1;0.75。
;故答案为:0.025 molL1min1;0.75。
⑷①由图可知,随温度的升高,乙烷的转化率再升高,考虑化学反应速率的影响因素,温度升高,反应速率加快,转化率升高;根据图中要使乙烷的转化率尽可能高,而副产物又相对较少,及乙烯的选择性较高,应找到乙烯收率较高时的温度,对应温度为850℃;故答案为:温度升高,反应速率加快,转化率升高;850℃。
②工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动;故答案为:正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动。

 优等生题库系列答案
优等生题库系列答案【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)

(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。

(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
【题目】将溶液(或气体)Y逐滴加入(或通入)一定量的溶液X中(下表),产生沉淀的物质的量(用纵坐标表示)与加入Y物质的量(用横坐标表示)的关系如图所示,则符合图中所示关系的一组物质是

A | B | C | D | |
X |
|
|
|
|
Y |
|
| NaOH | HCl |
A.AB.BC.CD.D


