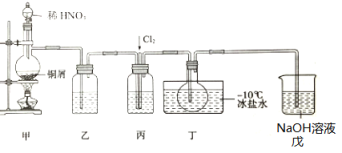
题目内容
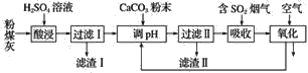
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)

(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
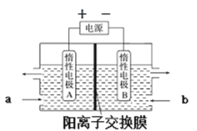
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
【答案】CaSO4 溶液温度下降,硫酸钠结晶析出时,夹裹了部分的硫酸锂共沉淀 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 4 碳酸锂产品的钙离子含量相对升高(或使得氢氧化铝溶解进入溶液,导致最终产品的纯度下降) CO2 a 2H2O+2e-=H2↑+2OH- Li2CO3+2C+2FeSO4![]() 2LiFePO4+3CO↑
2LiFePO4+3CO↑
【解析】
含锂电解铝废渣(主要成分为LiF、AIF3、NaF,少量CaO等)与浓硫酸反应生成Li2SO4、Al2(SO4)3、Na2SO4和CaSO4。CaSO4是微溶物,加水溶解,滤渣1为CaSO4,向滤液中加入Na2CO3溶液,碱解生成CO2气体、Al(OH)3和Na2SO4及Li2CO3,趁热过滤,向滤液中加入氧化钙生成CaSO4、Al(OH)3、LiOH,过滤,向滤液中加入CO2得到Li2CO3,电解得到LiOH。
(1)根据分析得到“滤渣1”主要成分是CaSO4;
(2)“过滤2”需要趁热在恒温装置中进行,根据表中溶解度曲线得出硫酸钠晶体析出可能会夹带着硫酸锂,从而导致Li2SO4的收率下降;故答案为:溶液温度下降,硫酸钠结晶析出时,夹裹了部分的硫酸锂共沉淀;
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝主要是碳酸根和铝离子发生双水解,其离子方程式为2Al3++3CO32+3H2O=2Al(OH)3↓+3CO2↑;若碱解前滤液中c(Li+)=4molL1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则此时溶液中c(Li+)=![]() ,根据
,根据![]() ,得到“滤液2”中
,得到“滤液2”中![]() ;
;
(4)“苛化”过程,若氧化钙过量,溶液中含有多余的钙离子,也可能将生成的氢氧化铝溶解进入得到溶解中;故答案为:碳酸锂产品的钙离子含量相对升高(或使得氢氧化铝溶解进入溶液,导致最终产品的纯度下降)。
(5)碱解的过程中生成CO2,在碳化过程中加入CO2,因此整个工艺流程中可以循环利用的物质有CO2;
(6)“电解”原理如图所示,LiOH是从右边得到,而锂离子通过阳离子交换膜进入到右室,因此“碳化”后的电解液应从a口注入。阴极是水中的氢离子得到电子,其电极反应式为2H2O+2e-=H2↑+2OH-;
(7)将电池级Li2CO3和C、FePO4高温下反应,根据氧化还原反应,FePO4中Fe化合价降低,则C化合价升高,生成LiFePO4和一种可燃性气体即CO,该反应的化学方程式为Li2CO3+2C+2FeSO4![]() 2LiFePO4+3CO↑。
2LiFePO4+3CO↑。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】无机化合物可根据其组成和性质进行分类。
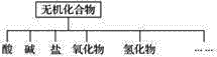
(1)上图所示的物质分类方法名称是____________。
(2)以钠、钾、氢、氧、碳、硫、氮中任两种或三种元素组成合适的物质,分别填在下表中的横线上:
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式__________。
(4)写出实验室由⑩制备氧气的化学方程式______。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________。