题目内容
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
【答案】C
【解析】A. 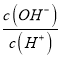 =1溶液呈中性, Fe2+和Al3+都能水解使溶液呈酸性,所以它们不能共存于碱性溶液,对应的离子方程式也是在酸性条件下才能发生的反应,所以A不正确; B. 由水电离出c(H+)=1×10-13mol·L-1,小于10-7mol/L,所以水的电离可能受到酸或碱的抑制。NH4+遇碱会发生反应生成一水合氨,所以它不能与碱大量共存;AlO2-遇到少量酸会生成氢氧化铝沉淀,遇到过量酸则转化为铝离子,所以它不能与酸大量共存。所以无论溶液是酸性还是碱性,总有离子不能大量共存,B不正确;C. 含有大量Al3+的溶液一定是酸性的,Na+、NH4+、SO42-、Cl-四种离子都能在酸性溶液中大量共存,C正确;D.二氧化硫有还原性,而次氯酸根有强氧化性,所以向此溶液中通入二氧化硫后,二氧化硫将被氧化为硫酸,而次氯酸根被还原为氯离子,所以D不正确。
=1溶液呈中性, Fe2+和Al3+都能水解使溶液呈酸性,所以它们不能共存于碱性溶液,对应的离子方程式也是在酸性条件下才能发生的反应,所以A不正确; B. 由水电离出c(H+)=1×10-13mol·L-1,小于10-7mol/L,所以水的电离可能受到酸或碱的抑制。NH4+遇碱会发生反应生成一水合氨,所以它不能与碱大量共存;AlO2-遇到少量酸会生成氢氧化铝沉淀,遇到过量酸则转化为铝离子,所以它不能与酸大量共存。所以无论溶液是酸性还是碱性,总有离子不能大量共存,B不正确;C. 含有大量Al3+的溶液一定是酸性的,Na+、NH4+、SO42-、Cl-四种离子都能在酸性溶液中大量共存,C正确;D.二氧化硫有还原性,而次氯酸根有强氧化性,所以向此溶液中通入二氧化硫后,二氧化硫将被氧化为硫酸,而次氯酸根被还原为氯离子,所以D不正确。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目



