��Ŀ����
����Ŀ��Ī���εĻ�ѧʽΪ( NH4)2Fe(SO4)2��6H2O������ˮ���������Ҵ�����������������ԭ�ζ��Ļ����������ȡĪ���εIJ���װ����ʵ�鲽�裺
�ٽ���м����С�ձ��У���������Na2CO3��Һ��С����ȼ����ӣ�������Һ��������ˮϴ����м�����ɡ�
������ƿ�м���2.24 g ��м������̼�ۣ��ɷ�Һ©���μ�20 mL 3 mol/L������Һ��
�۴���Ӧ�������ɷ�Һ©������������(NH4)2SO4��Һ�����ˡ�����Һ�м���һ�������Ҵ����������������ˡ�ϴ�ӡ����ɣ���Ī���ξ��塣
��ش��������⣺
��1��ʵ�鿪ʼǰ����鷴Ӧ�������Եķ���Ϊ_____________________��
��2���������Na2CO3��Һ��������_____________________________________��
��3��������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©���е�ԭ����__________________����������̼�۵�������_________________________________________��
��4��������������������2 mol/L ��(NH4)2SO4��Һ______________mL��
��5��ȡ10.00 g����ͭ��Ʒ�������еĸ�����ΪH2CrO4���ټ��������ữ�������250mL��Һ��ȡ��25.00 mL��Ũ��Ϊ0.0180 mol/L��(NH4)2Fe(SO4)2����Һ�ζ����յ�ʱ��ȥ��Һ20.75 mL����֪����H2CrO4����ԭΪCr3+����ζ�ʱ��Ӧ�����ӷ���ʽΪ_____________________________________������Ʒ�и�Ԫ�ص���������Ϊ______��
���𰸡� �ر�ֹˮ�У���Һ©����������ƿ�еμ�ˮ����һ��ʱ���ˮ���ܵ���������Ӧ�����������á����رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ���£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ��ܿڵ����γ�һ��ˮ������Ӧ�����������á��� ��ȥ��м��������� ��Һ�����ã�����ֹFe2+�������� ������ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���� 20 H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O 0.65��65%
����������1��ʵ�鿪ʼǰ����鷴Ӧ�������Եķ���Ϊ���ر�ֹˮ�У���Һ©����������ƿ�еμ�ˮ����һ��ʱ���ˮ���ܵ���������Ӧ�����������ã����رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ���£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ��ܿڵ����γ�һ��ˮ������Ӧ�����������ã�����ȷ�𰸣��ر�ֹˮ�У���Һ©����������ƿ�еμ�ˮ����һ��ʱ���ˮ���ܵ���������Ӧ�����������á����رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ���£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ��ܿڵ����γ�һ��ˮ������Ӧ�����������ã���
��2��Na2CO3��Һˮ���Լ��ԣ��ܹ������۷�����Ӧ������ϴ�������е����ۣ���ȷ�𰸣���ȥ��м��������ۡ�
��3��������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©���У��ܹ���Һ�����ã���ֹ������Fe2+����������̼��ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���ʣ���ȷ�𰸣���Һ�����ã�����ֹFe2+����������������ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���ʡ�
��4��2.24 g ��м��20 mL 3 mol/L������Һ��Ӧ���������������������Ϊ0.04mol������������������Ϊ0.04 mol��Ȼ�����(NH4)2SO4+FeSO4+6H2O =( NH4)2Fe(SO4)2��6H2O��Ӧ��֪����n(NH4)2SO4)=0.04 mol, ����c��V=n��֪��0.04=2��V��V=0.02L=20 mL����ȷ�𰸣�20��
��5�����������Ϣ��֪��H2CrO4�ܹ���(NH4)2Fe(SO4)2�е�������������Ϊ�����ӣ�������ԭΪCr3+����Ӧ�����ӷ���ʽΪH2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O�� ���ݷ�Ӧ��ϵ��H2CrO4-3Fe2+��֪��25.00 mL��Һ��n((NH4)2Fe(SO4)2)=n(Fe2+)=0.018��20.75��10-3=3.735��10-4mol, n( H2CrO4)=1.245��10-4mol,��250mL��Һ����n( H2CrO4)=1.245��10-3 mol��m(Cr)= 1.245��10-3��52g; ����Ʒ�и�Ԫ�ص���������Ϊ1.245��10-3��52/10��100%=65%����ȷ�𰸣�H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O��65%��0.65

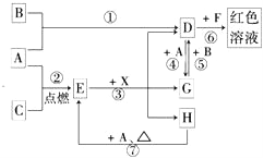
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����в�������������۾���ȷ���ǣ� ��
ѡ�� | ���� | ���� | ���� |
A | ��FeCl3��KSCN�����Һ�У���������KCl�Ĺ��� | ��Һ��ɫ��dz | FeCl3��3KSCN |
B | �����Һ�����ε�����ˮ��KSCN��Һ | ��Һ��Ϊ��ɫ | ����Һ�к���Fe2+ |
C | ��װ��X��Һ���Թ��е���ŨNaOH��Һ���������ɫʯ����ֽ�����Թܿ� | ���������� | X��Һ����NH4+ |
D | �Ҵ����ظ������Һ��� | ��ɫ��Һ��Ϊ��ɫ | �Ҵ����л�ԭ�� |
A. A B. B C. C D. D
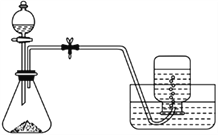
����Ŀ��Cl2OΪ���ʹ��ϸ�Ч��ȫ���������֮һ�������ػ�ɫǿ�̼������壬�е�3.8���۵�-116�档ʵ���ҿ�����ʪ��Cl2��Na2CO3��Ӧ��ȡ����Cl2O��װ�����£�ͼ��

�ش��������⣺
��1����Ũ����ֱ�ӵ���KMnO4�����ϾͿ��Բ���Cl2����ģ�¡�ͼ���ڡ�ͼ��A����������ȷ��װ��ͼ��������Ҫ�ı�ע��_______
��2��B���Լ�aӦѡ��______�������������ĸ����
a.CCl4 b.����NaCl��Һ c.ŨH2SO4 d.����NaHCO3��Һ
��3��ͨ����������������C�������ػ�ɫ������Cl2O�������ʳ�����Ϊ���壬����ʽΪ��________
Cl2+ Na2CO3+ == NaHCO3+ NaCl+ Cl2O
��4����C�з�Ӧ��Ĺ���ɷֽ��м��飬��д��ʵ�鲽���Լ�Ԥ�ڵ�����ͽ��ۡ�
��ѡʵ���Լ�������������ˮ��ϡHNO3��BaCl2��Һ��Ba(OH)2��Һ��AgNO3��Һ������ʯ��ˮ���Թܡ�С�ձ��������ܵ���Ƥ��������װ�á�
ʵ�鲽�� | ����ͽ��� |
����һ��ȡC�е�����������Ʒ���Թ��У��μ���������ˮ����ȫ�ܽ⣬Ȼ����Һ�ֱ�����a��b�Թ��С� | |
���������a�Թ��еμ�BaCl2��Һ�����á� | ����������֤�������в���Na2CO3 |
��������_______________ | _______________ |
�����ģ�_______________ | _______________ ��֤�������к���NaCl�� |