题目内容
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
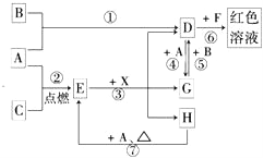
(1)写出下列物质的化学式:D___________,X_______________。
(2)在反应①~⑦中,不属于氧化还原反应的是_____________(填编号)。
(3)反应⑥的离子方程式为:______________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________。
(5)反应⑦的化学方程式为____________________________________;该反应中每消耗0.3mol的A,可转移电子________mol。
(6)除去D溶液中混有的少量G的化学方程式:_________________。
【答案】FeCl3 HCl ③⑥ Fe3++3SCN-=Fe(SCN)3 生成白色沉淀,迅速变为灰绿色,最终变为红褐色 3Fe+4H2O(g)![]() Fe3O4+4H2 0.8 2Fe2++Cl2=2Fe3++2Cl-
Fe3O4+4H2 0.8 2Fe2++Cl2=2Fe3++2Cl-
【解析】
单质A和C反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含SCN-离子的化合物,G为含Fe2+离子的化合物,H为H2O;依据G+B=D分析判断B是强氧化剂,B为黄绿色气体,证明为Cl2,所以推断D为FeCl3,得到G为FeCl2,X为HCl;依据判断出的物质回答问题。
根据以上分析可知A为金属Fe,B为Cl2,C为O2,D为FeCl3,E为Fe3O4,F为含SCN-离子的化合物,G为FeCl2,H为H2O,X为HCl;则
(1)依据分析推断可知,D为FeCl3,X为HCl;
(2)依据反应过程分析,①为铁和氯气发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和盐酸发生的反应,不是氧化还原反应,④为氯化铁和铁发生的氧化还原反应,⑤为氯化亚铁和氯气发生的氧化还原反应,⑥是氯化铁和SCN-发生的反应,不是氧化还原反应,⑦为铁和水蒸气发生的氧化还原反应生成四氧化三铁和氢气,则在反应①~⑦中,不属于氧化还原反应的是③⑥;
(3)反应⑥是氯化铁和SCN-发生的反应,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3;
(4)往G为FeCl2溶液中加入NaOH溶液观察到的现象是,生成白色氢氧化亚铁沉淀,被空气中氧气氧化为氢氧化铁,现象为生成白色沉淀,迅速变为灰绿色,最终变为红褐色;
(5)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;该反应中氢元素化合价从+1价变化为0价,4mol水反应转移电子为8mol,消耗3mol铁,则每消耗0.3mol的Fe,可转移电子0.8mol。
Fe3O4+4H2;该反应中氢元素化合价从+1价变化为0价,4mol水反应转移电子为8mol,消耗3mol铁,则每消耗0.3mol的Fe,可转移电子0.8mol。
(6)氯化亚铁易被氯气氧化为氯化铁,则除去FeCl3溶液中混有的少量FeCl2的方法是向混合溶液中通入足量的氯气,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。