题目内容
【题目】碳族元素(Carbon group)包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)、鈇(Fl)六种。
(1)已知Sn为50号元素,其价电子排布式为 ______;价电子中成对电子数为______个。
(2)已知CO与N2的结构相似,则CO的电子式为______,C、O、N第一电离能由大到小的顺序为______,三者最简单氢化物的熔沸点高低顺序为 ______(用“化学式”表示)。
(3)甲硅烷(SiH4)可用来制取超纯半导体硅,工业上采用Mg2Si和NH4Cl在液氨介质中反应制得甲硅烷,该反应的化学方程式为___________。
(4)碳酸氢钠的溶解度小于碳酸钠,是由于HCO3-能够形成双聚或多聚链状离子的结果,HCO3-中C原子的杂化方式为_______,HCO3-能够双聚或多聚的原因是__________。
(5) SiC作为C和Si唯一稳定的化合物,每个Si(或C)原子与周边包围的C(Si)原子通过________杂化相互结合。已经发现SiC具有250多种型体。某立方系晶体其晶胞参数为apm,阿伏加德罗常数的值为NA,该晶胞中原子的坐标参数为:
C部分原子:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
Si全部原子:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() )
)
该立方晶胞中Si原子构成的空间构型为_______,晶体的密度可表示为________g/cm3。
【答案】5s25p2 2 ![]() N>O>C H2O>NH3>CH4 Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2 sp2 HCO3-间能够通过氢键相互聚合 sp3 正四面体
N>O>C H2O>NH3>CH4 Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2 sp2 HCO3-间能够通过氢键相互聚合 sp3 正四面体 ![]() ×1030
×1030
【解析】
(1)已知Sn为50号元素,它是第五周期第IVA,根据其核外电子排布书写其价层电子排布式,结合泡利原理和洪特规则判断其价电子中成对电子数。
(2)根据等电子体结构相似,N2分子中2个N原子形成3对共用电子对; 一般情况下同一周期的元素的原子序数越大,元素的第一电离能就越大。但IIA、VA处于核外电子轨道的全满、半满的稳定状态,第一电离能大于相邻主族的元素;结合氢键、分子间作用力判断氢化物的熔沸点高低;
(3)Mg2Si和NH4Cl在液氨介质中反应制得甲硅烷、氨气和MgCl2,据此可得该反应的化学方程式;
(4)根据HCO3-中碳原子形成σ键数和孤电子对数判断C原子的杂化方式;HCO3-能够双聚或多聚与微粒间的氢键的存在有关;
(5)SiC中每个C与相邻的4个Si形成共价键,每个Si原子与相邻的4个C形成共价键,结合C、Si原子最外层电子数判断原子的杂化方式;根据晶胞中Si原子的位置可知其空间构型为正四面体形;结合晶胞中C、Si原子的坐标参数可确定一个晶胞中含有的C、Si原子个数,然后根据ρ=![]() 计算晶体的密度,注意单位的变换。
计算晶体的密度,注意单位的变换。
(1)Sn为50号元素,它是第五周期第IVA的元素,根据其核外电子排布可知其价层电子排布式为5s25p2,根据泡利原理和洪特规则,可知其价电子中成对电子数是2个5s电子;
(2)N2与CO互为等电子体,由于N2分子中2个N原子形成3对共用电子对,因此CO分子中C、O原子也是通过3对共用电子对结合,电子式为![]() ;C、O、N是同一周期 元素,一般情况下同一周期的元素的原子序数越大,元素的第一电离能就越大。但N元素为VA元素,由于其2p轨道的电子排布处于半满的稳定状态,所以其第一电离能大于O,故三种元素的第一电离能由大到小的顺序为:N>O>C;这三种元素的氢化物NH3、H2O、CH4,由于NH3、H2O分子之间除存在范德华力外,还存在分子间氢键,氢键大于范德华力,且氢键的数目H2O>NH3,作用力越大,克服这些作用力使物质熔化、气化消耗的能量就越高,所以物质的沸点由高到低的顺序为H2O>NH3>CH4;
;C、O、N是同一周期 元素,一般情况下同一周期的元素的原子序数越大,元素的第一电离能就越大。但N元素为VA元素,由于其2p轨道的电子排布处于半满的稳定状态,所以其第一电离能大于O,故三种元素的第一电离能由大到小的顺序为:N>O>C;这三种元素的氢化物NH3、H2O、CH4,由于NH3、H2O分子之间除存在范德华力外,还存在分子间氢键,氢键大于范德华力,且氢键的数目H2O>NH3,作用力越大,克服这些作用力使物质熔化、气化消耗的能量就越高,所以物质的沸点由高到低的顺序为H2O>NH3>CH4;
(3)Mg2Si和NH4Cl在液氨介质中反应制得甲硅烷、氨气和MgCl2,据此可得该反应的化学方程式为:Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2;
(4)在HCO3-中C原子形成2个C—O键和1个C=O键,即C原子形成3个σ键,且C上没有孤电子对,C原子的杂化方式是采用sp2杂化;HCO3-中含O—H键,HCO3-能够双聚或多聚是由于HCO3-间能够通过氢键相互聚合;
(5)SiC中每个C与相邻的4个Si形成共价键,每个Si原子与相邻的4个C形成共价键,结合C、Si原子最外层电子数都是4个,可知C、Si原子的杂化方式为sp3;结合晶胞中Si原子的位置可知其空间构型为正四面体形;根据给出的晶胞中部分C、全部Si原子的坐标参数可知Si原子在晶胞内部,一个晶胞中含有4个C、4个Si原子,则根据ρ=![]() =
=![]() ÷(a×10-10cm)3=
÷(a×10-10cm)3=![]() ×1030g/cm3。
×1030g/cm3。

【题目】甘氨酸亚铁![]() 是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
甘氨酸( | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程
实验1制备![]() :将含
:将含![]() 的溶液与
的溶液与![]() 溶液混合,反应结束后过滤并洗涤沉淀。
溶液混合,反应结束后过滤并洗涤沉淀。
实验2制备![]() :
:
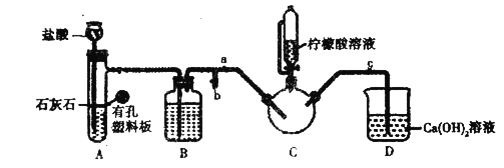
实验装置如图(夹持和加热仪器已省略),将实验1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反应将
中的反应将![]() 中空气排净,接着滴入柠檬酸溶液并加热。
中空气排净,接着滴入柠檬酸溶液并加热。
实验3提纯![]() :反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
:反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
(1)写出实验1中制备![]() 的离子方程式_________________。
的离子方程式_________________。
(2)装盐酸的仪器名称是__________,装置![]() 中的试剂是__________。
中的试剂是__________。
(3)实验2中,打开![]() 关闭
关闭![]() ,排尽空气。确认
,排尽空气。确认![]() 中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
(4)实验2中的柠酸可调节溶液![]() ,体系
,体系![]() 与产率的关系如表
与产率的关系如表
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
体系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
产率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 过低产率下降的原因是________________________;柠檬酸的作用还有_______。
过低产率下降的原因是________________________;柠檬酸的作用还有_______。
(5)实验3中加入乙醇的目的是____________________。
(6)若产品的质量为![]() ,则产率为__________________%。
,则产率为__________________%。




