题目内容
【题目】铁、钴、镍等过渡元素在工业生产和科学研究中具有重要作用,回答下列问题。
(1)![]() 简化的电子排布式为____________,第四电离能
简化的电子排布式为____________,第四电离能![]() ___
___![]() (填”>”或”<”)。
(填”>”或”<”)。
(2)![]() 常作净水剂和补铁剂,
常作净水剂和补铁剂,![]() 的空间构型为________,其中硫原子采用______杂化,任意写出一种
的空间构型为________,其中硫原子采用______杂化,任意写出一种![]() 的等电子体_______。
的等电子体_______。
(3)![]() 常温下呈液态;熔点为
常温下呈液态;熔点为![]() ,沸点为
,沸点为![]() ,易溶于非极性溶剂,据此可判断
,易溶于非极性溶剂,据此可判断![]() 晶体属于______(填晶体类型),若配合物
晶体属于______(填晶体类型),若配合物![]() 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则![]() _________。
_________。
(4)氮化铁晶体的晶胞如图所示,该氮化铁晶体的化学式为______。

(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的
代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的![]() 数目为________,
数目为________,![]() 与
与![]() 最短核间距为_________pm。
最短核间距为_________pm。
【答案】![]() < 正四面体 sp3
< 正四面体 sp3 ![]() (任写一种) 分子晶体 5
(任写一种) 分子晶体 5 ![]() 6
6 ![]()
【解析】
(1)Fe为26号元素,根据核外电子排布规律作答;
(2)结合价层电子对互斥理论与杂化类型及等电子体原理分析;
(3)依据分子晶体的物理性质分析;结合中心铁原子的价电子数及配体CO提供的电子数列式计算;
(4)用“均摊法”,计算出晶胞中含Fe与N的个数比,得出化学式;
(5)该晶胞模型为面心立方堆积,结合空间构型回答;根据晶胞参数等于相邻两个离子核间距的2倍作答。
(1)Fe在第四周期VIII族,基态原子简化的电子排布式为:![]() 3d64s2,则
3d64s2,则![]() 简化的电子排布式为
简化的电子排布式为![]() ;Co基态原子简化的电子排布式为:
;Co基态原子简化的电子排布式为:![]() 3d74s2,气态Co失去三个电子后会变成
3d74s2,气态Co失去三个电子后会变成![]() ,更易生成
,更易生成![]() ,因为此时最高能级d能级为半充满结构较稳定,则第四电离能
,因为此时最高能级d能级为半充满结构较稳定,则第四电离能![]() ,故答案为:
,故答案为:![]() ;<;
;<;
(2)![]() 的价层电子对数=4+
的价层电子对数=4+![]() =4,无孤电子对,则其空间构型为正四面体,杂化类型为sp3;等电子体是指价电子数相同,原子数相同,结构相似的离子或分子,则与
=4,无孤电子对,则其空间构型为正四面体,杂化类型为sp3;等电子体是指价电子数相同,原子数相同,结构相似的离子或分子,则与![]() 互为等电子体的有
互为等电子体的有![]() (任写一种即可),故答案为:正四面体;sp3;
(任写一种即可),故答案为:正四面体;sp3;![]() (任写一种即可);
(任写一种即可);
(3)![]() 常温下呈液态;熔点为
常温下呈液态;熔点为![]() ,沸点为
,沸点为![]() ,易溶于非极性溶剂,符合分子晶体的物理性质,因此可判断
,易溶于非极性溶剂,符合分子晶体的物理性质,因此可判断![]() 为分子晶体;中心原子铁价电子数为8,配体CO提供2个电子形成配位键,因此x=(18-8)/2=5,故答案为:分子体;8;
为分子晶体;中心原子铁价电子数为8,配体CO提供2个电子形成配位键,因此x=(18-8)/2=5,故答案为:分子体;8;
(4)氮化铁晶胞为六棱柱,顶点贡献率为1/6,棱点贡献率为1/3,面点贡献率为1/2,观察晶胞可知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,2个N位于体内,用“均摊法”可知,1个晶胞中含铁微粒数:12×1/6+2×1/2+3=6个,含氮微粒数:2个,该晶体中铁、氮的微粒个数之比为=6:2=3:1,则化学式为:![]() ;
;
(5)根据晶胞图可知,氧化亚铁晶胞类似氯化钠晶胞,棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍。上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,用“均摊法”,晶胞中含Fe2+:8×1/8+6×1/2=4个,含O2-:12×1/4+1=4个,晶胞的化学式为FeO,氧化亚铁中氧离子、亚铁离子个数比为1:1,所以,有6个O2-与Fe2+紧邻且等距离;
1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短核间距为dpm,1molFeO的质量为72g,氧化亚铁晶体的密度为ρ gcm-3,则有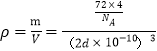 ,解得d=
,解得d=![]() pm,所以Fe2+与O2-的最短核间距为
pm,所以Fe2+与O2-的最短核间距为![]() pm,故答案为:6;
pm,故答案为:6;![]() 。
。

【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃