��Ŀ����
����Ŀ���ʰ�������![]() ��һ�ֲ���ǿ�����㷺����ȱ����ƶѪ��Ԥ�������ơ�ijѧϰС������������������Һ��ʰ��ᷴӦ�Ʊ��ʰ����������й��������������
��һ�ֲ���ǿ�����㷺����ȱ����ƶѪ��Ԥ�������ơ�ijѧϰС������������������Һ��ʰ��ᷴӦ�Ʊ��ʰ����������й��������������
�ʰ���( | ������ | �ʰ������� |
������ˮ�������Ҵ������Ի����� | ������ˮ���Ҵ�����ǿ���Ժͻ�ԭ�� | ������ˮ���������Ҵ� |
ʵ�����
ʵ��1�Ʊ�![]() ������
������![]() ����Һ��
����Һ��![]() ��Һ��ϣ���Ӧ��������˲�ϴ�ӳ�����
��Һ��ϣ���Ӧ��������˲�ϴ�ӳ�����
ʵ��2�Ʊ�![]() ��
��
ʵ��װ����ͼ(�гֺͼ���������ʡ��)����ʵ��1�õ��ij����ͺ�![]() �ʰ����ˮ��Һ��Ϻ����
�ʰ����ˮ��Һ��Ϻ����![]() �С�����
�С�����![]() �еķ�Ӧ��
�еķ�Ӧ��![]() �п����ž������ŵ�����������Һ�����ȡ�
�п����ž������ŵ�����������Һ�����ȡ�
ʵ��3�ᴿ![]() ����Ӧ�������������Һ����Ũ���������Ҵ������ˡ�����õ���Ʒ��
����Ӧ�������������Һ����Ũ���������Ҵ������ˡ�����õ���Ʒ��
(1)д��ʵ��1���Ʊ�![]() �����ӷ���ʽ_________________��
�����ӷ���ʽ_________________��
(2)װ���������������__________��װ��![]() �е��Լ���__________��
�е��Լ���__________��
(3)ʵ��2�У���![]() �ر�
�ر�![]() ���ž�������ȷ��
���ž�������ȷ��![]() �п����ž���ʵ��������________________���ž���������е�ʵ�������________�����ŵ�����������Һ�����ȡ�
�п����ž���ʵ��������________________���ž���������е�ʵ�������________�����ŵ�����������Һ�����ȡ�
(4)ʵ��2�е�����ɵ�����Һ![]() ����ϵ
����ϵ![]() ����ʵĹ�ϵ���
����ʵĹ�ϵ���
ʵ�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
��ϵ | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
����(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() ���Ͳ����½���ԭ����________________________������������û���_______��
���Ͳ����½���ԭ����________________________������������û���_______��
(5)ʵ��3�м����Ҵ���Ŀ����____________________��
(6)����Ʒ������Ϊ![]() �������Ϊ__________________%��
�������Ϊ__________________%��
���𰸡�![]() ����©�� ����̼��������Һ
����©�� ����̼��������Һ ![]() �г���ʯ��ˮ����� ��
�г���ʯ��ˮ����� ��![]() �ر�
�ر�![]()
![]() ���ͣ������ӻ���ʰ����еİ�����Ӧ ��ֹ�������ӱ����� ���ٸʰ����������ܽ�������ʹ��ᾧ���� 80.00
���ͣ������ӻ���ʰ����еİ�����Ӧ ��ֹ�������ӱ����� ���ٸʰ����������ܽ�������ʹ��ᾧ���� 80.00
��������
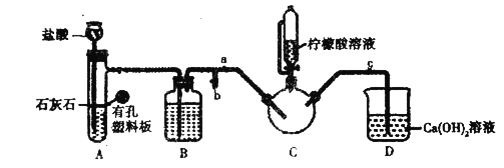
FeSO4��Һ��NH4HCO3��Һ��Ӧ�Ʊ�FeCO3��������FeCO3��ͺ�0.20mol�ʰ����ˮ��Һ��Ϻ����C�У�Ȼ������A�еķ�Ӧ��C�п����ž������ŵ�����������Һ�����ȣ���Ӧ��������ˣ���Һ�������ᾧ�����ˡ�ϴ�ӡ������õ���Ʒ��
��1��������������̼��������ӷ�Ӧ����̼����������
��2�����������ṹ���������װ��B�Լ���Ŀ���dz�ȥ������̼�е��Ȼ��⣻
��3������ʵ��������������������
��4��NH2CH2COOH�еİ��������������ӽ�ϣ��ݴ˷�������������ǿ���Ժͻ�ԭ�ԣ�
��5�����ݸʰ�������������ˮ���������Ҵ�������
��6���������⣬FeCO3������0.20mol�ʰ��ᷴӦ��ȫ�����������غ��й�ϵʽ��2NH2CH2COOH����NH3CH3COO��2Fe���������ϵõ��ģ�NH3CH3COO��2Fe�����ʵ���Ϊ![]() n��NH2CH2COOH��=0.10mol������Ϊ0.01mol��204g/mol=20.4g���ݴ˼��㡣
n��NH2CH2COOH��=0.10mol������Ϊ0.01mol��204g/mol=20.4g���ݴ˼��㡣
��1��Fe2����HCO3��������Ӧ����FeCO3������CO2��H2O�����ӷ���ʽΪ��Fe2++2HCO3��=FeCO3��+CO2��+ H2O���ʴ�Ϊ��Fe2++2HCO3��=FeCO3��+CO2��+ H2O��
��2��װ���������Ϊ����©�����Լ�B��Ҫ��Ϊ�˳�ȥ������̼�е��Ȼ��⣬��Ϊ����̼��������Һ���ʴ�Ϊ������©��������̼��������Һ��
��3����C�г���CO2��CO2��ʼ����D�У�ʹD�еij���ʯ��ˮ����ǣ���ʱ˵��C�п����Ѿ��ž����ʴ�Ϊ��D�г���ʯ��ˮ����ǣ�����A�еķ�Ӧ��C�п����ž���![]() �ر�
�ر�![]() ���ŵ�����������Һ�����ȣ��ʴ�Ϊ��
���ŵ�����������Һ�����ȣ��ʴ�Ϊ��![]() �г���ʯ��ˮ����ǣ���
�г���ʯ��ˮ����ǣ���![]() �ر�
�ر�![]() ��
��
��4��NH2CH2COOH�еİ����Լ��ԣ�pH����ʹ�����½���ԭ����H+����NH2CH2COOH��Ӧ��������Ϣ����������л�ԭ�Ժ�ǿ���ԣ��ܹ��ٽ�FeCO3���ܽ⣬��ֹFe2����������
�ʴ�Ϊ��![]() ���ͣ������ӻ���ʰ����еİ�����Ӧ����ֹ�������ӱ�����
���ͣ������ӻ���ʰ����еİ�����Ӧ����ֹ�������ӱ�����
��5�����ڸʰ�������������ˮ���������Ҵ�����Ϊ���ʰ����������ܽ�ȣ���߲��ʺʹ��ȣ����Ҵ�ϴ�ӣ��ʴ�Ϊ�����ٸʰ����������ܽ�������ʹ��ᾧ������
��6���������⣬FeCO3������0.20 mol�ʰ��ᷴӦ��ȫ,���������غ��й�ϵʽ��2NH2CH2COOH(NH3CH3COO)2Fe��
�������ϵõ���(NH3CH3COO)2Fe�����ʵ���Ϊ12n(NH2CH2COOH)=0.10
�����Ϊ��![]() =80.00%���ʴ�Ϊ��80.00%��
=80.00%���ʴ�Ϊ��80.00%��






