题目内容
8.CO和CO2的混合气体32g,共含有氧原子1.25mol,则混合气体中CO的质量为21g.分析 根据物质的原子构成结合CO和CO2的混合气体32g、共含有氧原子1.25mol,设未知数求方程进行计算即可.
解答 解:设:CO的物质的量是x,CO2的物质的量是y,则28x+44y=32g,x+2y=1.25mol,解得x=0.75mol,y=0.25mol,所以混合气体中CO的质量为0.75mol×28g/mol=21g,故答案为:21g.
点评 本题考查物质的量的相关计算,注意把握相关物理量的计算公式,从质量守恒的角度列式计算,题目难度不大.

练习册系列答案
相关题目
14.在化学反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,中下列说法不正确的是( )
| A. | 氢元素是还原剂 | B. | O2是氧化剂 | C. | H2发生氧化反应 | D. | O2被还原 |
16.元素周期表中前20号不同周期的四种元素A、B、C、D,原子序数依次递增,可形成离子化合物DA、CB、D2B,可形成共价化合物A2B、若A、D同族,则上述物质中有关离子半径大小顺序正确的是( )
| A. | D>C>B>A | B. | B>C>D>A | C. | D>B>C>A | D. | C>D>A>B |
3.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图1所示:

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
(1)加入NaOH溶液主要为了除去Mg2+(填离子符号),发生反应的离子方程式为MgCO3+2OH-=Mg(OH )2↓+CO32-;“沉淀”的主要成份有Mg(OH)2、Fe(OH)3、CaCO3(填化学式); 向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
20.下列共价化合物中所有原子都满足最外层8电子结构的是( )
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
18.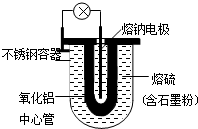 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的负极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |


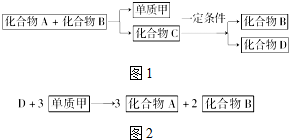 A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:
A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系: