题目内容
20.下列共价化合物中所有原子都满足最外层8电子结构的是( )| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
分析 共价化合物分子中,中心原子的最外层电子数与成键数之和为8,则分子中所有原子都满足最外层8电子结构,据此进行解答.
解答 解:A、XeF6中Xe原子的原子核外最外层电子数为8,其在分子中的化合价为+6价,在分子中的原子最外层电子数为14,故A错误;
B、次氯酸中,H原子的最外层满足2个电子,故B错误;
C、氯化硫(S2Cl2)结构式是Cl-S-S-Cl,S原子的原子核外最外层电子数为6,每个S原子形成2个共价键,所以满足最外层8电子结构;Cl原子的原子核外最外层电子数为7,其在分子中的化合价为-1价,所以满足最外层8电子结构,故C正确;
D、白磷P4的结构式为 ,P原子最外层电子数是5,每个P原子形成3个共价键,所以白磷中P原子满足8电子结构,故D正确.
,P原子最外层电子数是5,每个P原子形成3个共价键,所以白磷中P原子满足8电子结构,故D正确.
故选CD.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列说法不正确的是( )
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
11.由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-,将该混合物溶于水后得澄清溶液,现取3份各100mL的该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是Ba2+、Mg2+;
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)试确定K+存在(填是或否)存在.
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
(1)根据实验①对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是Ba2+、Mg2+;
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度/mol•L-1 |
5.下列各种物质不属于新型无机非金属材料的是( )
| A. | 水泥 | B. | 氮化硅陶瓷 | C. | 磷酸钙陶瓷 | D. | 氧化铝陶瓷 |
9.下列离子方程式书写正确的是( )
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向Ca(ClO2)溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
10.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用10mL量筒量取7.36mLNaOH 溶液 | |
| B. | 用托盘天平称取6.85g食盐 | |
| C. | 用标准的盐酸滴定未知浓度的NaOH 溶液,用去盐酸21.10mL | |
| D. | 用广泛pH 试纸测得某溶液pH 为5.5 |
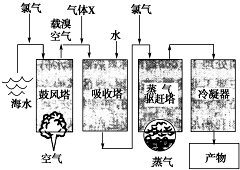 如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题: