题目内容
3.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图1所示:
已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图2所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
分析 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、和Cl-、SO42ˉ等杂质,加入水溶解后加入氢氧化钠溶液过滤得到滤液通过蒸发浓缩,冷却结晶,趁热过滤得到碳酸钠晶体,加热脱水得到实际级碳酸钠,母液重新溶解循环使用;
(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀;
(2)根据碳酸钠溶液中碳酸根离子的水解是吸热反应判断;
(3)使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,36℃是一个转折点;
(4)通过观察两个热化学方程式,利用盖斯定律来计算焓变即可;
(5)分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响.
解答 解:(1)碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,主要是除去镁离子,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3,发生的发应有:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg (OH) 2↓+CO32-,Mg2++2OH-=Mg (OH) 2↓,当两种沉淀共存且溶液的pH=8时,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L;
c(Mg2+):c(Fe3+)=$\frac{Ksp(Mg(OH)_{2})}{{c}^{2}(O{H}^{-})}$:$\frac{Ksp(Fe(OH)_{3})}{{c}^{3}(O{H}^{-})}$=$\frac{5.61×1{0}^{-12}}{(1{0}^{-8})^{2}}$:$\frac{2.64×1{0}^{-39}}{(1{0}^{-8})^{3}}$=2.125×1021;
故答案为:Mg2+;MgCO3+2OH-=Mg(OH )2↓+CO32-; Mg2++2OH-=Mg (OH) 2↓;Mg(OH)2、Fe(OH)3、CaCO3;2.125×1021;
(2)热的Na2CO3溶液有较强的去油污能力,是由于Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强,
故答案为:Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强;
(3)“趁热过滤”的原因是使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,所以温度高于36℃,
故答案为:高于36℃;
(4)通过观察两个热化学方程式,利用盖斯定律,可将两式相减得到Na2CO3•H2O(S)═Na2CO3(s)+H2O(g),
即Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol,
故答案为:Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol;
(5)若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质,这样不符合该提纯工艺,
故答案为:不可行;若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
点评 本题考查了物质的分离、提纯及物质的制取等知识,题目难度中等,本题是一道比较综合的试题题,有利于考查学生分析和解决问题的能力.

| 选项[来 | 实验 | 现象 | 结论 |
| A | 常温下,等量等表面积的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | FeCl3溶液用于刻蚀铜制印刷电路板 | 溶液变蓝 | 氧化性:Cu2+>Fe2+ |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
(1)根据实验①对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是Ba2+、Mg2+;
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度/mol•L-1 |
| A. | Na2O2只作氧化剂 | |
| B. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | 每生成16g氧气就有1mol Fe2+ 被还原 | |
| D. | Na2FeO4既是还原产物又是氧化产物 |
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |

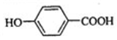 ;
;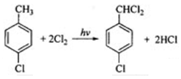 ,该反应类型为取代反应;
,该反应类型为取代反应;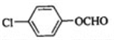 (写结构简式).
(写结构简式).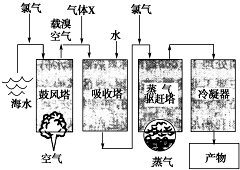 如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题: