题目内容
19.(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)?2NH3(g)①在反应体系中加入催化剂,反应速率增大,该反应的反应热不变(填“增大”、“减小”或“不变”).
②5分钟后达到平衡,测得N2为0.2mol,H2为0.6mol,NH3为0.2mol.氮气的平均反应速率v(N2)=0.01mol•L-1•min-1,H2的转化率为33.3%(保留小数点后一位).
③欲提高②容器中H2的转化率,下列措施可行的是AD.
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g)△H=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
分析 (1)①在反应体系中加入催化剂,加快反应速率,反应热只与始态与终态有关,与反应途径无关;
②由方程式可知△n(N2)=$\frac{1}{2}$△n(NH3),△n(H2)=$\frac{3}{2}$△n(NH3),再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(N2),转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
③A.把气体的体积压缩至1L,压强增大,平衡正向移动;
B.向容器中再充入惰性气体,恒容条件下,各组分浓度不变,平衡不移动;
C.改变反应的催化剂不影响平衡移动;
D.液化生成物分离出氨,平衡正向移动;
(2)由表中数据可知,随温度升高,NH3生成量增大,说明升高温度平衡正向移动,则正反应为吸热反应.
解答 解:(1)①在反应体系中加入催化剂,降低活化能,活化分子百分数增大,反应速率增大,反应热只与始态与终态有关,与反应途径无关,反应热不变,
故答案为:增大;不变;
②由方程式可知△n(N2)=$\frac{1}{2}$△n(NH3)=$\frac{1}{2}$×0.2mol=0.1mol,v(N2)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol•L-1•min-1;
△n(H2)=$\frac{3}{2}$△n(NH3)=$\frac{3}{2}$×0.2mol=0.3mol,氢气起始物质的量=0.3mol+0.6mol=0.9mol,故氢气转化率=$\frac{0.3mol}{0.9mol}$×100%=33.3%,
故答案为:0.01mol•L-1•min-1;33.3%;
③A.把气体的体积压缩至1L,压强增大,平衡正向移动,H2的转化率增大,故A正确;
B.向容器中再充入惰性气体,恒容条件下,各组分浓度不变,平衡不移动,H2的转化率不变,故B错误;
C.改变反应的催化剂不影响平衡移动,H2的转化率不变,故C错误;
D.液化生成物分离出氨,平衡正向移动,H2的转化率增大,故D正确,
故选:AD;
(2)由表中数据可知,随温度升高,NH3生成量增大,说明升高温度平衡正向移动,则正反应为吸热反应,故a>0,故答案为:大于.
点评 本题考查化学平衡计算与影响因素、反应速率计算等,难度不大,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 常温下,将0.1mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{{c(CH}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| B. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| C. | 常温下,0.1mol•L-1HA溶液与0.1mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| D. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 |
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
| A. | 0.7 mol | B. | 0.9 mol | C. | 1.1 mol | D. | 1.3 mol |
| A. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为 453.2g | |
| B. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) | |
| C. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为40% | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
| A. | 胶体外观不均一 | B. | 胶体能产生丁达尔效应 | ||
| C. | 胶体能透过滤纸 | D. | 胶体粒子直径在1-100 nm之间 |
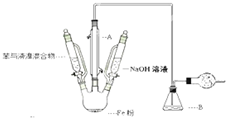 苯与液溴制取溴苯
苯与液溴制取溴苯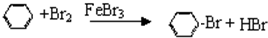 反应类型:取代反应
反应类型:取代反应
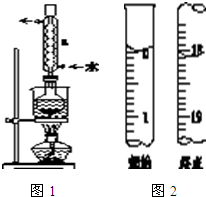 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.