题目内容
3.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
分析 (1)氧化铝是两性氧化物溶于强酸强碱;
(2)依据氧化还原反应电子守恒和原子守恒,结合元素化合价变化分析产物和反应物;
(3)依据金属阳离子沉淀开始和完全沉淀需要的溶液PH分析,亚铁离子被氧化为铁离子,调节溶液PH使铁离子全部沉淀;
(4)①浓盐酸和二氧化锰再加热条件下生成黄绿色气体氯气;
②加入MnSO4至紫红色消失,目的是除去过量高锰酸根离子.
解答 解:(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)高锰酸根离子在酸溶液中被还原为锰离子,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,
故答案为:1、5、8H+、1、5、4H2O;
(3)向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液pH为1.5--2.8,铝离子和亚铁离子开始沉淀的溶液pH大于3,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离,
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(4)一定条件下,MnO4-可与Mn2+反应生成MnO2
①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体,
故答案为:生成黄绿色气体;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
故答案为:除去过量的MnO4-.
点评 本题考查了镁、铝、铁及其化合物性质的应用,主要是混合物分离的方法和实验设计,加入氧化剂氧化亚铁离子,调节溶液PH是沉淀分离是解题的关键,题目难度中等.

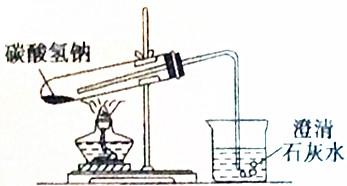
| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
| A. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为 453.2g | |
| B. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) | |
| C. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为40% | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
| A. | 0.5 mol•L-1 CuCl2溶液中含有3.01×1023个Cu2+ | |
| B. | 标准状况下,2.24 L CO2气体含有1.81×1023个氧原子 | |
| C. | 48 g O3气体含有6.02×1023个O3分子 | |
| D. | 标准状况下,33.6 L H2O含有1.5NA个H2O分子 |

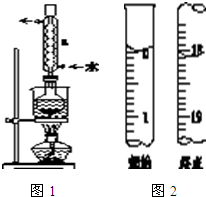 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.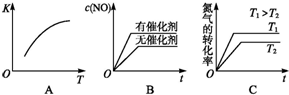 汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答: