题目内容
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。请回答:
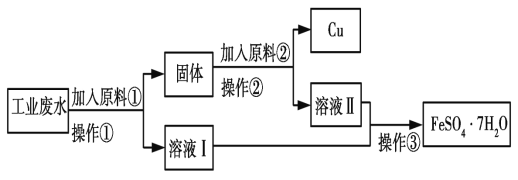
(1)反应①的离子方程式为______。
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成分是_____。(填名称)。
(4)原料②的名称为_____。
Ⅱ.回收的铜可用于制备胆矾(CuSO4·5H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O。 制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾。
2CuSO4+2H2O。 制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾。
(1)请分析2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,氧化剂是_____,氧化产物是____(填化学式)。
2CuSO4+2H2O反应中,氧化剂是_____,氧化产物是____(填化学式)。
(2)用双线桥标出上述反应的电子得失_____。
2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
(3)若有147gH2SO4 参与反应,则转移的电子数目为_____。
【答案】Fe+Cu2+=Fe2++Cu abc 铜和铁 稀硫酸 O2 CuSO4 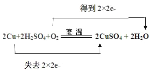 3NA
3NA
【解析】
Ⅰ.由流程图可知,向工业废水中加入过量的铁粉,铁与铜离子发生置换反应生成铜和亚铁离子,过滤,得到含有铜和铁的滤渣和硫酸亚铁溶液;向滤渣中加入适量的稀硫酸,使铁与稀硫酸反应生成硫酸亚铁和氢气,过滤,得到铜和硫酸亚铁溶液;将所得硫酸亚铁溶液混合,经过蒸发浓缩、冷却结晶、过滤、洗涤可得绿矾;
Ⅱ. 由方程式可知,反应中铜元素化合价升高,失电子被氧化,氧元素化合价降低,得电子被还原,O2是氧化剂,Cu是还原剂。
(1)反应①为铁与铜离子发生置换反应生成铜和亚铁离子,反应的离子方程式为Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
(2)操作①为固体和液体分离,该操作名称为过滤,过滤用到的玻璃仪器有:a.烧杯、b.漏斗、c.玻璃棒,故答案为:abc;
(3)由分析可知固体成分为铁和铜的混合物,故答案为:铜和铁;
(4)操作①中加入过量的铁才能使铜离子完全反应,所以所得固体的成分是铁和铜,分离铁和铜且回收铜,所以加入某物质与铁反应,与铜不反应,且与铁反应后的物质与操作①所得溶液中溶质的成分一样,加入的物质为稀硫酸,故答案为:稀硫酸;
Ⅱ.(1)由方程式可知,反应中铜元素化合价升高,失电子被氧化,氧元素化合价降低,得电子被还原,O2是氧化剂,Cu是还原剂,硫酸铜是氧化产物,故答案为:O2;CuSO4;
(2)由方程式可知,反应消耗2mol铜和1mol氧气转移4mol电子,则用双线桥表示反应的电子得失为 ,故答案为:
,故答案为: ;
;
(3)由方程式可知,反应消耗2mol硫酸转移4mol电子,147g硫酸的物质的量为![]() =1.5mol,则转移的电子数目为1.5mol×4×
=1.5mol,则转移的电子数目为1.5mol×4×![]() ×NA mol—1=3 NA,故答案为:3 NA。
×NA mol—1=3 NA,故答案为:3 NA。

 阅读快车系列答案
阅读快车系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数