题目内容
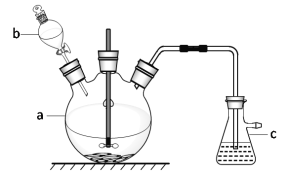
【题目】镍、钴及其化合物在工业上应用广泛。从某含镍废渣(含主要成分为Ni、CoO、Co2O3 及少量杂质Al2O3)提取碳酸钴、硫酸镍的工艺如下:

已知:25℃,Ksp[Co(OH)2]=4.0×10-15, lg2=0.3
(1)酸浸时需将含镍废渣粉碎,目的是_______,酸浸时通入SO2的作用是________。
(2)“除铝”时发生反应的离子方程式是______________________,25℃,若“沉钴”开始时c (Co2+) = 0.010 mo/L,则控制pH≤______时不会产生Co(OH)2沉淀。
(3)一定浓度的NiSO4溶液中加入适量的NaClO和NaOH混合液,可制得NiOOH沉淀,该反应的化学方程式为________。NiOOH可用于制备碱性镍氢电池,该电池工作原理: NiOOH+ MH![]() Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
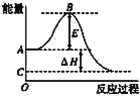
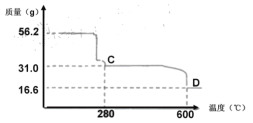
(4) NiSO4溶液可经过操作A得到NiSO4·7H2O晶体,俗称“翠矾”,操作A具体是指______________。煅烧该晶体时剩余固体质量与温度变化曲线如图,已知该曲线中D处所得产物均为氧化物,写出C到D的化学方程式______________。
【答案】增大接触面积,加快反应速率,提高镍的浸出率,提高产率 将Co3+还原为Co2+ Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 7.8 2NiSO4+NaClO+4NaOH=2NiOOH↓+NaCl+Na2SO4+H2O Ni(OH)2+OH--e-=NiOOH+H2O 加热浓缩、冷却结晶、过滤 2NiSO4![]() Ni2O3+SO2↑+SO3↑
Ni2O3+SO2↑+SO3↑
【解析】
某含镍废渣(含主要成分为Ni、CoO、Co2O3 及少量杂质Al2O3)加入硫酸酸浸,酸浸后的溶液中含有Ni2+、Co2+、Co3+、Al3+,通入SO2,将Co3+还原为Co2+,加入碳酸钠调节溶液pH,使Al3+全部转化为沉淀,过滤,向滤液中加入萃取剂得到含Co2+水溶液和有机层,沉钴中加入足量的碳酸氢钠溶液,得到碳酸钴;有机层处理后得NiSO4溶液。NiSO4溶液经蒸发浓缩、冷却结晶、得NiSO4·7H2O晶体,煅烧该晶体的NixOy。
(1)酸浸时需将含镍废渣粉碎,目的是增大接触面积,加快反应速率,提高镍的浸出率,提高产率;酸浸时通入SO2的作用是将溶液中的Co3+还原为Co2+;
(2)“除铝”时,溶液中的Al3+与CO32-发生水解反应生成氢氧化铝和二氧化碳,反应的离子方程式是Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ ;若“沉钴”开始时c (Co2+) = 0.010 mol/L,c (Co2+)×c2(OH-)= 0.010 mo/L×c2(OH-)≤4.0×10-15,c(OH-)≤2×10-6.5mo/L,c(H+)![]()
![]() mo/L=2-1×10-7.5 mo/L,故pH≤7.8;
mo/L=2-1×10-7.5 mo/L,故pH≤7.8;
(3)一定浓度的NiSO4溶液中加入适量的NaClO和NaOH混合液,NaClO将Ni2+氧化,反应的化学方程式为2NiSO4+NaClO+4NaOH=2NiOOH↓+NaCl+Na2SO4+H2O;NiOOH可用于制备碱性镍氢电池,该电池工作原理: NiOOH+ MH![]() Ni(OH)2+M(M为储氢合金),电池充电时阳极发生氧化反应,故阳极的电极反应式是Ni(OH)2+OH--e-=NiOOH+H2O;
Ni(OH)2+M(M为储氢合金),电池充电时阳极发生氧化反应,故阳极的电极反应式是Ni(OH)2+OH--e-=NiOOH+H2O;
(4)从NiSO4溶液得到NiSO4·7H2O晶体的具体操作依次为加热浓缩、冷却结晶、过滤;
n(NiSO4·7H2O)=![]() =0.2mol,n(NiSO4·7H2O)=n(NiSO)=n(Ni),煅烧NiSO4·7H2O晶体生成NiSO4的质量为:0.2mol×155g/mol=31.0g,故C点为NiSO4,D点16.6g中n(O)=
=0.2mol,n(NiSO4·7H2O)=n(NiSO)=n(Ni),煅烧NiSO4·7H2O晶体生成NiSO4的质量为:0.2mol×155g/mol=31.0g,故C点为NiSO4,D点16.6g中n(O)=![]() =0.3mol,故n(Ni):n(O)=0.2mol:0.3mol=2:3,D点生成Ni2O3,所以C到D的化学方程式2NiSO4
=0.3mol,故n(Ni):n(O)=0.2mol:0.3mol=2:3,D点生成Ni2O3,所以C到D的化学方程式2NiSO4![]() Ni2O3+SO2↑+SO3↑。
Ni2O3+SO2↑+SO3↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。