题目内容
【题目】〔化学﹣﹣选修2:化学与技术〕 锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题: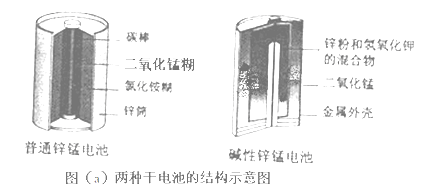
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH ①该电池中,负极材料主要是 , 电解质的主要成分是 , 正极发生的主要反应是 .
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是 .
(2)图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属). 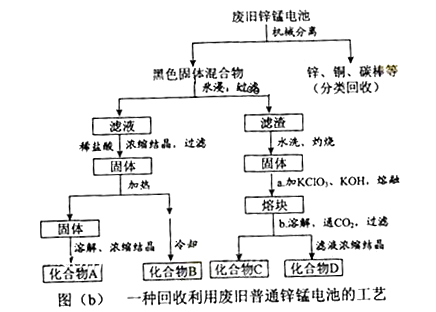
①图(b)中产物的化学式分别为A , B .
②操作a中得到熔块的主要成分是K2MnO4 . 操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为 .
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是(填化学式).
【答案】
(1)锌;NH4Cl;MnO2+NH4++e﹣=MnOOH+NH3;碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高
(2)ZnCl2;NH4Cl;3MnO42﹣+2CO2=2MnO4﹣+MnO2↓+2CO32﹣;H2
【解析】解:(1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,反应中Zn被氧化,为电池负极锌,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e﹣=MnOOH+NH3 . 与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高;故答案为:①锌;NH4Cl;MnO2+NH4++e﹣=MnOOH+NH3②碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高.(2)废电池经机械分离后,加水溶解后溶液中的成分是氯化铵,再加稀盐酸Zn溶解生成氯化锌,因此浓缩结晶得到氯化铵和氯化锌.氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌.绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42﹣+2CO2=2MnO4﹣+MnO2↓+2CO32﹣ . 采用惰性电极电解K2MnO4溶液,阴极氢离子得电子生成氢气.故答案为:①ZnCl2 NH4Cl②3MnO42﹣+2CO2=2MnO4﹣+MnO2↓+2CO32﹣l③H2(1)①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;②根据碱性锌锰电池的特点分析;(2)①根据电池的材料分析;
②根据已知反应物和产物,再利用元素守恒③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.

【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:

(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________,补填的玻璃仪器在过滤时,起到了______________的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________;在铁棒周围的溶液里滴加酚酞溶液,溶液变________色。

(3)写出电解饱和食盐水的化学方程式:____________________________。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
含碘量 | 20~40 mg·kg-1 |
保质期 | 18个月 |
食用方法 | 勿长时间炖炒 |
贮藏指南 | 避热、避光、密封、防潮 |
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__mol,该“加碘食盐”的含碘量为__mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为___________mol·L-1。