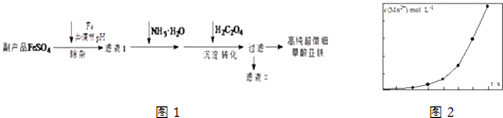
��Ŀ����
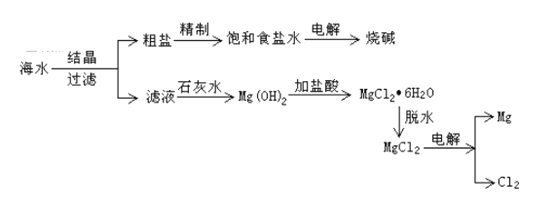
����Ŀ���Ӻ�ˮ�п���ȡ���ֻ�����Ʒ����ͼ�ǹ�ҵ�϶Ժ�ˮ��һ���ۺ����õ�����ͼ��
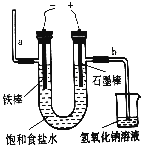
��1������ʱ����Ҫ��������Ϊ�ձ���©����_________������IJ��������ڹ���ʱ������______________�����á�
��2����ͼΪ���ʳ��ˮ��װ�ã�ʯī�缫�ϲ���������Ϊ_________����������Χ����Һ��μӷ�̪��Һ����Һ��________ɫ��
��3��д����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽ��____________________________��
��4���±���ij���ӵ�ʳ������װ���ϵIJ�������˵��.
���� | �Ȼ���(NaCl)�������(KIO3) |
������ | 20��40 mg��kg��1 |
������ | 18���� |
ʳ�÷��� | ��ʱ������ |
����ָ�� | ���ȡ��ܹ⡢�ܷ⡢���� |
�پ��ⶨ�������ӵ�ʳ������KIO3�ĺ���Ϊ42.8 mg��kg��1������ÿǧ�����ӵ�ʳ������KIO3�����ʵ���Ϊ__mol�������ӵ�ʳ�����ĺ�����Ϊ__mg��kg��1��
�ڽ�5.0 g�����ӵ�ʳ��������ˮ�����100 mL��Һ������Һ��IO3���������ʵ���Ũ��Ϊ___________mol��L��1��
���𰸡� ������ ���� ��������Cl2�� �� 2NaCl+2H2O![]() C12��+ H2��+2NaOH 0.0002 25.4 1��10��5
C12��+ H2��+2NaOH 0.0002 25.4 1��10��5
����������1��ʵ���ҶԺ�ˮ���й���ʱ������Ҫ��������Ϊ�ձ���©���Ͳ��������������ڹ��˲����������������ã���2����ⱥ��ʳ��ˮ�����Դ����������FeΪ�������������Դ�������ӵĵ缫ʯīΪ������������Һ��������������ʧ���ӷ���������Ӧ����������ʯī�缫�ϲ���������Ϊ��������Һ���������������õ����ӷ�����ԭ��Ӧ�����������缫����ˮ�ĵ���ƽ�ⱻ�ƻ�������������Ũ��������Һ�Լ��ԣ���������Χ����Һ��μӷ�̪����Һ���ɫ����3����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ2NaCl+2H2O![]() C12��+H2��+2NaOH����4����n=m/M=0.0428g��214g/mol=0.0002mol����˸����ӵ�ʳ�����ĺ�����Ϊ0.0002��127��1000��25.4mg��kg��1����5.0g�����е���ص����ʵ�����5g/1000g��0.0002mol=0.000001mol��������Һ��IO3-�������ʵ���Ũ��Ϊ0.000001mol��0.1L=0.00001mol/L��
C12��+H2��+2NaOH����4����n=m/M=0.0428g��214g/mol=0.0002mol����˸����ӵ�ʳ�����ĺ�����Ϊ0.0002��127��1000��25.4mg��kg��1����5.0g�����е���ص����ʵ�����5g/1000g��0.0002mol=0.000001mol��������Һ��IO3-�������ʵ���Ũ��Ϊ0.000001mol��0.1L=0.00001mol/L��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�