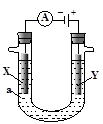题目内容
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
C
解析试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。铜的金属性强于银的,因此铜是负极,银是正极,在外电路中,电流由银电极流向铜电极,①不正确;正极是溶液中的Ag+得到电子,电极反应式是Ag++e-=Ag,②正确;实验过程中取出盐桥,相当于断路,不能构成原电池,③不正确;将铜片浸入AgNO3溶液中发生铜和硝酸银发生置换反应,生成银和硝酸铜,发生的化学反应与该原电池反应相同,④正确,答案选C。
考点:考查原电池的有关判断和应用
点评:该题是基础性试题的考查,主要是考查学生对原电池原理的应用、判断的熟悉了解程度,意在巩固学生的基础,提高学生的应试能力和学习效率。明确原电池的工作原理是答题的关键,注意盐桥的作用。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
A.负极的电极反应式为:CO+O2- 2e-=CO2 2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
关于下列各图的说法,正确的是
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
关于如图装置的叙述,不正确的是( )
| A.铝是负极,铝片上析出无色气体 |
| B.石墨是正极,石墨棒上析出黄绿色气体 |
| C.溶液中两电极间产生白色沉淀 |
| D.溶液中Na+向石墨方向移动 |
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9 ]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为 224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是
| A.a电极与电源的负极相连 |
| B.t2时,两电极的质量相差3.84 g |
| C.电解过程中,溶液的pH不断增大 |
| D.t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
某同体酸燃料电池以Ca(HSO )
)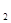 固体为电解质传递H
固体为电解质传递H ,其基本结构如图所示,电池总反应可表示为:2H
,其基本结构如图所示,电池总反应可表示为:2H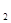 +O
+O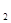 =2H
=2H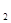 O,下列有关说法错误的是
O,下列有关说法错误的是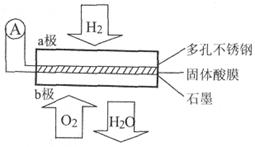
| A.电子通过外电路从a极流向b极 |
B.b极上的电极反应式为:O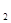 +4H +4H +4e +4e =2H =2H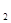 O O |
| C.每转移0.4 mol电子,生成3.6g水 |
D.H 由b极通过固体酸电解质传递到a极 由b极通过固体酸电解质传递到a极 |
下列有关金属腐蚀与防护的说法正确的是( )
| A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
| A.电子由锌片经导线流向铜片 | B.铜片作正极,锌片作负极 |
| C.溶液中SO42- 的物质的量浓度保持不变 | D.溶液中Cu2+移向负极 |