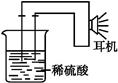
题目内容
某同体酸燃料电池以Ca(HSO )
)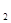 固体为电解质传递H
固体为电解质传递H ,其基本结构如图所示,电池总反应可表示为:2H
,其基本结构如图所示,电池总反应可表示为:2H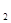 +O
+O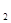 =2H
=2H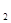 O,下列有关说法错误的是
O,下列有关说法错误的是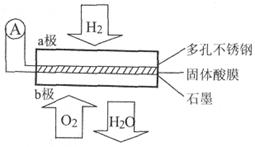
| A.电子通过外电路从a极流向b极 |
B.b极上的电极反应式为:O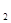 +4H +4H +4e +4e =2H =2H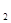 O O |
| C.每转移0.4 mol电子,生成3.6g水 |
D.H 由b极通过固体酸电解质传递到a极 由b极通过固体酸电解质传递到a极 |
D
解析试题分析:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-=2H+;通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L。
A、a为负极,b是正极,则电子应该是通过外电路由a极流向b,故A正确;
B、该电池为酸性电池,所以正极电极反应为O2+4e-+4H+=2H2O,故B正确;
C、每转移0.4 mol电子,生成0.2mol水,质量是0.2mol×18g/mol=3.6g,故C正确;
D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D错误,答案选D。
考点:考查燃料电池的工作原理的有关判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题。侧重考查学生灵活运用原电池原理解决实际问题的能力。学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题。

下列实验现象预测正确的是
| A.实验I:电流表A指针偏转,碳棒上有红色固体析出 |
| B.实验II:电流表A指针偏转,铁极上有无色气体产生 |
| C.实验III:碳棒上有无色气体产生,铁极上有黄绿色气体产生 |
| D.实验IV:粗铜溶解,精铜上有红色固体析出 |
有关下列电化学装置的说法中正确的是
| A.图a是原电池装置,可以实现化学能转化为电能 |
| B.图b电解一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )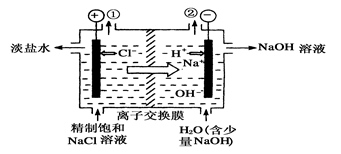
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
在理论上可用来设计原电池的反应是
| A.Fe +2HCl =" Fe" Cl2+ H2 |
| B.NaOH +HCl="NaCl+" H2O |
| C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4 |
| D.Ca CO3+2HCl=" Ca" Cl2+ H2O+ CO2 |
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
 Fe2++H2↑。
Fe2++H2↑。