题目内容
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9 ]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为 224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是
| A.a电极与电源的负极相连 |
| B.t2时,两电极的质量相差3.84 g |
| C.电解过程中,溶液的pH不断增大 |
| D.t2时,b电极的电极反应是2H2O-4e-=2OH-+H2↑ |
B
解析试题分析: 阳极先产生氯气后产生氧气;阴极先析出铜后逸出氢气。a电极为阳极,A错误;a电极所得混合气体为氯气和氧气,由氯气体积得混合溶液中Cl-为0.02mol,由氯化铝和硫酸铜物质的量比1:9得溶液中Cu2+为0.06mol,所以t2时阴极析出0.06molCu,质量为3.84g,B正确;电解过程中相当于依次电解氯化铜溶液、硫酸铜溶液、硫酸铝溶液,C错误;b电极为阴极,得电子发生还原反应,D错误。
考点: 电化学

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq)  2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)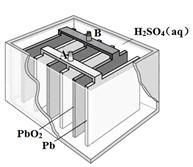
下列说法不正确的是
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
下列叙述正确的是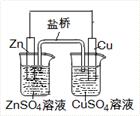
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.上图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O |
下列叙述正确的是
| A.用饱和NaHCO3溶液可以将混在CO2气体中的HCl除去 |
| B.能使润湿的淀粉KI试纸变蓝的气体一定是Cl2 |
| C.某“海水”电池的总反应为:5MnO2+2Ag+2NaCl==Na2Mn5O10+2AgCl,每生成1 mol Na2Mn5O10转移2 mol电子 |
| D.在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下: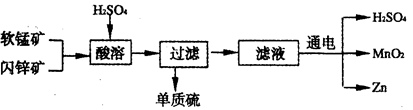
下列说法正确的是
| A.酸溶时,MnO2作还原剂 | B.可用盐酸代替硫酸进行酸溶 |
| C.原料硫酸可以循环使用 | D.在电解池的阴极处产生MnO2 |
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )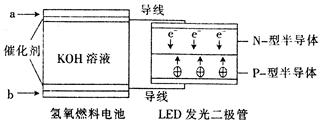
| A.a处通人氧气,b处通人氢气 |
| B.该装置中只涉及两种形式的能量转化 |
| C.电池正极电极反应式为O2+2H2O+4e-﹦4OH- |
| D.P一型半导体连接的是电池负极 |
下列关于下图所示原电池装置的叙述正确的是( )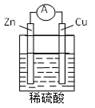
| A.铜片是负极 | B.铜片质量逐渐减少 |
| C.氢离子在铜片表面被还原 | D.电流从锌片经导线流向铜片 |