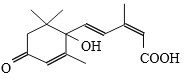
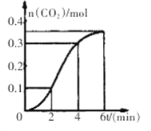
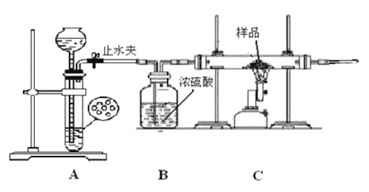
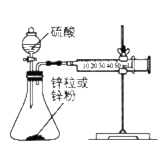
题目内容
【题目】反应2A(s)+B(g) ![]() 2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
A.用A表示的反应速率是![]()
B.分别用B、C、D表示反应的速率,其比是1∶2∶1
C.2min末时的反应速率用反应物B来表示的是![]()
D.在2min内用B和C表示的反应速率的值是相同的
【答案】B
【解析】
A、物质A是固体,浓度不变,不能用A表示该反应的反应速率,选项A错误;
B、速率之比等于化学计量数之比,v(B):v(C):v(D)=1:2:1,选项B正确;
C、2min末的反应速率为即时速率,用B表示速率0.3mol/(Lmin),是2min内的平均速率,选项C错误;
D、B是反应物,浓度降低,C是生成物,浓度增大,选项D错误;
答案选B。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
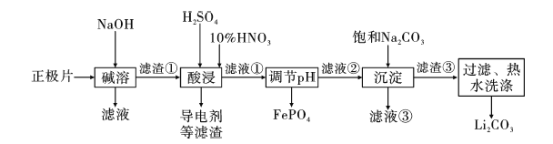
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L