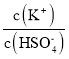题目内容
【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。
【答案】 ac 3.33×10-7 mol/(L·h) 催化剂在80℃活性减小,反应速率反而减慢 选择高效催化剂、提高温度、及时将产物移出反应容器 N2(g)+3H2(g)
ac 3.33×10-7 mol/(L·h) 催化剂在80℃活性减小,反应速率反而减慢 选择高效催化剂、提高温度、及时将产物移出反应容器 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2 kJ/mol 391
2NH3(g) △H=-92.2 kJ/mol 391
【解析】
(1)化学平衡常数K等于可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比;
(2)该反应的正反应是吸热反应,利用温度对化学平衡移动的影响分析;
(3)第四组容器中3小时内以NH3表示的平均反应速率v=![]() ;催化剂的催化作用是在一定温度范围内,温度过高或过低都导致催化剂催化效果降低;
;催化剂的催化作用是在一定温度范围内,温度过高或过低都导致催化剂催化效果降低;
(4)该反应是一个反应前后气体体积增大的吸热反应,选择合适的催化剂、提高温度或减少生成物浓度都影响该反应;
(5)合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则生成2 mol氨气放出92.2 kJ热量;
(6)反应热等于反应物的总键能减去生成物的总键能。
(1)可逆反应2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g)的化学平衡常数K=
4NH3(g) +3O2(g)的化学平衡常数K= ;
;
(2)a. 该反应的正反应为吸热反应,升高温度,化学平衡正向移动,平衡常数增大,a正确;
b. H2O是液体,物质的浓度恒定不变,b错误;
c. 升高温度,化学平衡向正反应方向移动,气体的物质的量增大,由于容器的容积恒定不变,所以容器内的气体的压强增大,c正确;
d. 升高温度,物质分子内能增加,分子之间碰撞次数增加,活化分子数增加,活化分子百分数增大,导致v逆(O2)增大,d错误;
故合理选项是ac;
(3)由3小时内根据NH3浓度的变化量,得v(NH3)=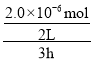 =3.33×10-7 mol/(Lh),第四组温度最高但达到平衡时,氨气的物质的量最小,可能是催化剂在80℃活性降低,反应速率反而减慢;
=3.33×10-7 mol/(Lh),第四组温度最高但达到平衡时,氨气的物质的量最小,可能是催化剂在80℃活性降低,反应速率反而减慢;
(4)进行工业生产,要反应速率快,转化率高,从速率方面考虑应选择高效催化剂、提高温度,从转化率方面考虑应及时将产物移出反应容器;
(5)合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则生成2 mol氨气放出92.2 kJ热量,该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2 kJ/mol;
2NH3(g) △H=-92.2 kJ/mol;
(6)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则945.8 kJ/mol+3×436 kJ/mol -6x=-92.2 kJ/mol,解得x=391 kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0