题目内容
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
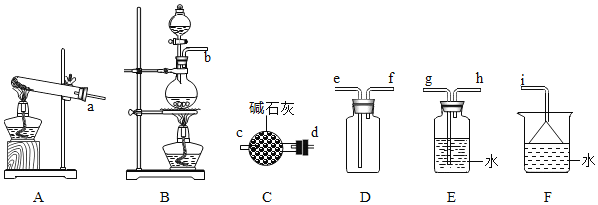
(2)氨气的发生装置可以选择上图中的________,反应的化学方程式为_______________。
(3)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_________(按气流方向,用各接口小写字母表示)。
(4)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。
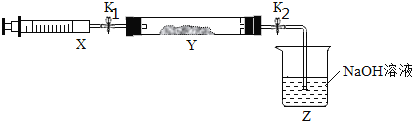
在一定温度下按上图所示装置进行实验。
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | Y管中______ | 反应的化学方程式:___ |
将注射器活塞退回原处并固定,将装置恢复到室温 | Y管中有少量水珠 | 生成的气态水冷凝 |
打开K2 | _________ | ________ |
【答案】A Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O d→c→f→e→i 红棕色气体颜色变浅最终为无色 8NH3+6NO2
CaCl2+2NH3↑+2H2O d→c→f→e→i 红棕色气体颜色变浅最终为无色 8NH3+6NO2![]() 7N2+12H2O Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压
7N2+12H2O Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压
【解析】
本题是实验室制氨气的实验探究活动。一般在实验室中,利用氢氧化钙与氯化铵混合加热发生复分解反应制取氨气,由于反应物均为固体,因此选用略向下倾斜试管进行实验。发生该反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;在对气体进行除杂、干燥时,考虑到氨气是碱性气体,所以需要利用碱性干燥剂进行干燥,又因为氨气的密度比空气的密度小且极易溶于水,因此氨气只能用向下排空气法收集。最后为了防止氨气对环境产生污染,需要对氨气进行尾气处理。
CaCl2+2NH3↑+2H2O;在对气体进行除杂、干燥时,考虑到氨气是碱性气体,所以需要利用碱性干燥剂进行干燥,又因为氨气的密度比空气的密度小且极易溶于水,因此氨气只能用向下排空气法收集。最后为了防止氨气对环境产生污染,需要对氨气进行尾气处理。
(2)在实验室中,利用氢氧化钙与氯化铵混合加热发生复分解反应制取氨气,由于反应物均为固体,因此选用A装置进行实验。发生该反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。答案为:A、Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O。答案为:A、Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)利用A装置制取氨气,由于氨气是碱性气体,所以需要利用碱性干燥剂碱石灰进行干燥,再根据氨气的密度比空气的密度小这一性质,需用向下排空气法收集氨气 ,最后因为氨气对环境具有一定的污染性,需要进行尾气处理,可利用其在水中极容易溶解的性质,用水作吸收剂进行尾气处理。因此欲收集一瓶干燥的氨气,其装置的连接顺序为:发生装置→d→c→f→e→i。答案为:d→c→f→e→i ;
(4)NO2具有强氧化性,NH3有强还原性,两者相遇,会发生氧化还原反应产生氮气和水,根据电子守恒、原子守恒,可得反应的方程式:8NH3+6NO2![]() 7N2+12H2O,根据反应方程式可知反应现象是:Y管内看到红棕色气体颜色变浅最终为无色,同时在注射器的内壁有水珠产生。答案为:红棕色气体颜色变浅最终为无色、8NH3+6NO2
7N2+12H2O,根据反应方程式可知反应现象是:Y管内看到红棕色气体颜色变浅最终为无色,同时在注射器的内壁有水珠产生。答案为:红棕色气体颜色变浅最终为无色、8NH3+6NO2![]() 7N2+12H2O;
7N2+12H2O;
根据上一步分析可知发生该反应后由于容器内气体的物质的量减少,所以会使容器内气体压强减小。因此当打开K2后,烧杯内NaOH溶液在大气压强的作用下会倒吸进入Y管内。答案为:Z中NaOH溶液产生倒吸现象、反应后气体分子数减少,Y管中压强小于外压。