题目内容
【题目】ClO2是一种优良的消毒剂,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,实验室在50℃时制备ClO2。
实验Ⅰ:制取并收集ClO2,装置如图所示:
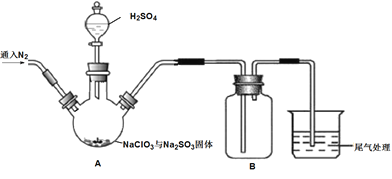
(1)写出用上述装置制取ClO2的化学反应方程式_____________。
(2)装置A中持续通入N2的目的是___________。装置B应添加__________(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。
实验Ⅱ:测定装置A中ClO2的质量,设计装置如图:
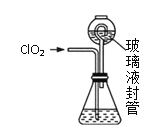
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I+S4O62-)。
(3)装置中玻璃液封管的作用是_____________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m(ClO2)=_______g(用整理过的含c、V的代数式表示)。
【答案】![]() 降低ClO2的浓度,防止ClO2的浓度过高而发生分解,引起爆炸 冰水浴 防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量 溶液由蓝色变为无色,并且在30s内颜色不发生变化 1.35×10-2cV
降低ClO2的浓度,防止ClO2的浓度过高而发生分解,引起爆炸 冰水浴 防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量 溶液由蓝色变为无色,并且在30s内颜色不发生变化 1.35×10-2cV
【解析】
Ⅰ.(1)根据题给信息可知:NaClO3与亚硫酸钠在酸性条件下反应生成ClO2和硫酸钠等物质;
(2)二氧化氯(ClO2)沸点为11℃,NaClO3与亚硫酸钠在酸性条件下生成二氧化氯等物质, ClO2浓度过高时易发生分解引起爆炸,ClO2的沸点低,用冰水可以使ClO2冷凝为液体;
Ⅱ. (3)用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等,准确测量;
(4)溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
(5)根据氧化还原反应分析,有关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2)。
Ⅰ.(1)根据题给信息可知:NaClO3与亚硫酸钠在酸性条件下反应生成ClO2和硫酸钠等物质,则化学反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)二氧化氯(ClO2)沸点为11℃,NaClO3与亚硫酸钠在酸性条件下生成二氧化氯等物质, ClO2浓度过高时易发生分解引起爆炸,通入氮气,及时排出;ClO2的沸点低,用冰水可以使ClO2冷凝为液体,故答案为:降低ClO2的浓度,防止ClO2的浓度过高而发生分解,引起爆炸;冰水浴;
Ⅱ. (3)装置中玻璃液封管的作用是,防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量,故答案为:防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量;
(4)当滴入(最后)一滴标准液时,溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点,故答案为:溶液由蓝色变为无色,并且在30s内颜色不发生变化;
(5)VmLNa2S2O3溶液含有Na2S2O3物质的量n(Na2S2O3)=V10-3 L×cmol/L=cV10-3 mol.则:根据关系式: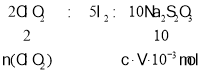 ,所以n(ClO2)=
,所以n(ClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×cV10-3 mol,所以m(ClO2)=n(ClO2) M=
×cV10-3 mol,所以m(ClO2)=n(ClO2) M=![]() ×cV10-3 mol×67.5g/mol=1.35cV×10-2g,故答案为:1.35cV×10-2。
×cV10-3 mol×67.5g/mol=1.35cV×10-2g,故答案为:1.35cV×10-2。

【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生如下反应:2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.NO和O2的物质的量之比保持不变
D.每消耗1 molO2同时生成2 molNO
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度:
CH3OH(g),达平衡后测得各组分浓度:
物质 | CO | H2 | CH3OH |
浓度(mol/L) | 0.9 | 1.0 | 0.6 |
回答下列问题:
①混合气体的平均相对分子质量=_________________。
②平衡常数K=__________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正______v逆(填“>”、“<”或“=”)。