题目内容
以下有关原子结构及元素周期律的叙述正确的是
A. 是中子数不同质子数相同的同种核素 是中子数不同质子数相同的同种核素 |
| B.第IA族金属元素是同周期中金属性最强的元素 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.短周期元素形成离子后,最外层都达到8电子稳定结构 |
B
解析试题分析:A、这两种微粒质子数相同中子数不同,是两种核素,错误;B、正确;C、同主族非金属性从上到下减弱,其氢化物的稳定性也逐渐减弱,错误;D、氢、锂等元素形成的离子不能满足8电子稳定结构,错误。
考点:考查原子结构及元素周期律有关问题。

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列各组顺序的排列错误的是
| A.金属性:Na<Mg<Al | B.热稳定性:HCl>H2S>PH3 |
| C.酸性强弱:H4SiO4<H2CO3<HNO3 | D.熔点:金刚石>食盐>干冰 |
在一定条件下,含短周期元素R的离子RO3n-与R2-发生如下反应:RO3n- +2R2- +6H+=3R+3H2O,下列关于元素R的叙述中正确的是
| A.R原子的最外层上有4个电子 | B.RO3n-中的R只能被还原 |
| C.R的最外层电子排布式是nsnnp2n | D.HnRO4一定是强酸 |
短周期元素X、Y、 Z、W在元素周期表中的位置如下表,且Z族元素的化合物种类最多。则下列说法正确的是
| | X | | Y |
| Z | | W | |
A.Z单质的熔点是四种单质中最低的
B.Y的最高价氧化物的水化物酸性最强
C.碳元素可与W形成直线型分子
D.ZY4是由极性键形成的极性分子
短周期元素W、X、Y和Z的原子序数依次增大。其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3。根据以上叙述,下列说法中正确的是
| A.以上四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列各组中的性质比较,不正确的是( )
| A.稳定性:NH3<PH3<SiH4 | B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 | D.还原性:F-<Cl-<Br- |
如图是两个氢原子相互接近时的能量变化图,则有关该图的说法正确的是( )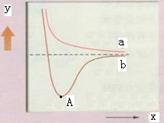
| A.y代表两原子之间的核间距 |
| B.x代表体系具有的能量 |
| C.a代表核外电子自旋相反的两个氢原子能量变化 |
| D.A点时表示两原子间形成了稳定的共价键 |
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是
| A.X元素气态氢化物的水溶液呈酸性 |
| B.X能形成化学式为NaXO3的含氧酸钠盐 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的