题目内容
1911年前后,英国物理学家卢瑟福用带正电的 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的 粒子的运动轨迹,能正确反映实验结果的图是( )
粒子的运动轨迹,能正确反映实验结果的图是( )
D
解析试题分析:如果а粒子正撞原子核会反弹,如果а粒子撞到原子核的边缘会转向,如果а粒子没有撞到原子核会直接通过,符合这些现象的为D项。
考点:本题考查卢瑟福的а粒子轰击金箔实验。

练习册系列答案
相关题目
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,能层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
| A.Y与Z的最高正价之和等于9 |
| B.Y的气态氢化物比W的稳定 |
| C.原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.XY2与ZY2中的化学键类型相同 |
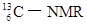 (核磁共振)可以用于含碳化合物的结构分析,有关
(核磁共振)可以用于含碳化合物的结构分析,有关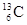 的说法正确的是( )
的说法正确的是( )
| A.质子数为6 | B.电子数为13 | C.中子数为6 | D.质量数为6 |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |
下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
下列叙述正确的是( )
| A.同一主族的元素,原子半径越大,其单质的熔点一定越高 |
| B.同一周期元素的原子,半径越小越容易失去电子 |
| C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 |
| D.稀有气体元素的原子序数越大,其单质的沸点一定越高 |
以下有关原子结构及元素周期律的叙述正确的是
A. 是中子数不同质子数相同的同种核素 是中子数不同质子数相同的同种核素 |
| B.第IA族金属元素是同周期中金属性最强的元素 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.短周期元素形成离子后,最外层都达到8电子稳定结构 |