题目内容
19.高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子.制取高铁酸钠的化学方程式如下:2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O(1)在上述化学方程式上标出该反应中电子转移的方向和数目.
(2)在上述反应中铁(填元素名称)元素被氧化,氧化剂是Cl2.
(3)当有2.408×1024个电子发生转移时,参加反应的氯气在标准状况下的体积为44.8L.
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂.在水处理过程中,Na2FeO4中的铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉,Fe(OH)3胶体中分散质粒子直径的范围是10-9m~10-7m或1nm~100nm.
分析 (1)该反应中Fe元素化合价由+3价变为+6价,Cl元素化合价由0价变为-1价;
(2)失电子化合价升高的元素被氧化,得电子化合价降低的反应物是氧化剂;
(3)根据氯气和转移电子之间的关系式计算消耗氯气体积;
(4)胶体微粒直径在10-9m~10-7m或1 nm~100nm之间.
解答 解:(1)该反应中Fe元素化合价由+3价变为+6价,Cl元素化合价由0价变为-1价,转移电子总数为6, ,
,
故答案为: ;
;
(2)该反应中Fe元素化合价由+3价变为+6价,Cl元素化合价由0价变为-1价,该反应中Fe元素化合价升高被氧化,Cl2是氧化剂,故答案为:铁;Cl2;
(3)设消耗氯气气体体积为x,
2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O转移电子
67.2L 6×6.02×1023
x 2.408×1024
67.2L:6×6.02×1023=x:2.408×1024
x=$\frac{2.408×1{0}^{24}×67.2L}{6×6.02×1{0}^{23}}$=44.8L,
故答案为:44.8L;
(4)胶体微粒直径在10-9m~10-7m或1 nm~100nm之间,胶体能产生丁达尔效应,故答案为:10-9m~10-7m或1 nm~100nm.
点评 本题考查氧化还原反应,涉及氧化还原反应计算、基本概念等知识点,明确各个物理量之间关系即可解答,知道常见元素化合价.

练习册系列答案
相关题目
7.不能通过单质之间化合反应得到的化合物是( )
| A. | CuCl2 | B. | FeCl2 | C. | HCl | D. | Na2O2 |
14.下列变化中,必须加入氧化剂才能发生的是( )
| A. | NaI→AgI | B. | CO2→CO | C. | Cl2→Ca(C1O)2 | D. | Na→NaOH |
11.下列反应不属于可逆反应的是( )
| A. | Cl2溶于水 | |
| B. | NH3溶于水 | |
| C. | 可充电电池的反应如H2O+Zn+Ag2O$?_{充电}^{放电}$Zn(OH)2+Ag | |
| D. | 电解水生产H2和O2,点燃H2和O2的混合物生产水 |
11.下列说法正确的是( )
| A. | 离子化合物可能含共价键 | |
| B. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| C. | 离子化合物中只含离子键 | |
| D. | 离子化合物中一定含有金属离子 |
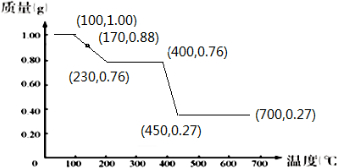
12.称取含有结晶水的草酸镁(MgC2O4•nH2O)样品(代号A)1.00克后,由25℃徐徐加热至700℃.在加热过程中,不断通入一大气压的惰性气体,结果A的质量随温度的增高而减少的情况如下表所示.已知A在100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水.
(1)试以温度为横轴(X),质量为纵轴(Y),绘出样品A的质量随温度而改变的图,标出坐标.(注意题干中带有着重号的叙述)
(2)MgC2O4的相对分子质量为112.A的化学式是MgC2O4•2H2O.
(3)写出样品在400℃~450℃间发生的化学反应方程式:MgC2O4$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{400℃~450℃}$MgO+CO↑+CO2↑.
| 温度/℃ | 25 | 170 | 230 | 400 | 450 | 700 |
| 质量/g | 1.00 | 0.88 | 0.76 | 0.76 | 0.27 | 0.27 |


(2)MgC2O4的相对分子质量为112.A的化学式是MgC2O4•2H2O.
(3)写出样品在400℃~450℃间发生的化学反应方程式:MgC2O4$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{400℃~450℃}$MgO+CO↑+CO2↑.
 如图为硬脂酸甘油酯在碱性条件下水解的装置图.进行皂化反应时的步骤如下:
如图为硬脂酸甘油酯在碱性条件下水解的装置图.进行皂化反应时的步骤如下: 化学与生活:防治环境污染,改善生态环境已成为全球的共识.
化学与生活:防治环境污染,改善生态环境已成为全球的共识.