题目内容
2.下列关于反应热的说法正确的是( )| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径和反应条件无关 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1,说明碳的燃烧热为110.5 kJ•mol-1 | |
| D. | 在25℃、1.01×105 Pa时,Ba(OH)2稀溶液与稀硫酸反应生成1 mol H2O放出的热量为57.3KJ |
分析 A.根据焓变的表示方法分析;
B.反应热(△H)=生成物的总能量-反应物的总能量;
C.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;
D.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,中和热为放热反应,中和热为57.3 kJ/mol,生成硫酸钡沉淀时要放热.
解答 解:A.依据焓变的表示方法分析,焓变△H>0说明反应吸热,△H<0说明反应放热,故A错误;
B.反应热(△H)=生成物的总能量-反应物的总能量,所以反应热只与反应体系的始态和终点状态有关,而与反应的途径无关,故B正确;
C.碳的燃烧热是指1mol碳完全燃烧生成的稳定的氧化物CO2放出的热量,从2C(s)+O2(g)=2CO(g)△H=-221kJ/mol可知1mol碳燃烧生成CO放出110.5 kJ,故△H=-110.5 kJ/mol不是碳的燃烧热,故C错误;
D.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,中和热为放热反应,中和热为57.3 kJ/mol,但是Ba2+与SO42-生成沉淀时放热,所以稀硫酸与Ba(OH)2稀溶液反应的中和热数值大于57.3 kJ/mol,故D错误;
故选B.
点评 本题考查了化学反应能量变化的分析判断,中和热概念的分析,注意生成沉淀时放热,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.对于有机物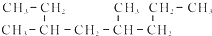 的命名正确的是( )
的命名正确的是( )
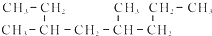 的命名正确的是( )
的命名正确的是( )| A. | 4-甲基-6-乙基庚烷 | B. | 3,5-二甲基辛烷 | ||
| C. | 2-甲基-1,4-二乙基戊烷 | D. | 3,6-二甲基辛烷 |
7.不能通过单质之间化合反应得到的化合物是( )
| A. | CuCl2 | B. | FeCl2 | C. | HCl | D. | Na2O2 |
14.下列变化中,必须加入氧化剂才能发生的是( )
| A. | NaI→AgI | B. | CO2→CO | C. | Cl2→Ca(C1O)2 | D. | Na→NaOH |
11.下列反应不属于可逆反应的是( )
| A. | Cl2溶于水 | |
| B. | NH3溶于水 | |
| C. | 可充电电池的反应如H2O+Zn+Ag2O$?_{充电}^{放电}$Zn(OH)2+Ag | |
| D. | 电解水生产H2和O2,点燃H2和O2的混合物生产水 |
15.化学概念间存在如图三种关系下列说法中正确的是:( )
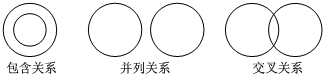

| A. | 化合反应与氧化反应属于包含关系 | |
| B. | 吸热反应与放热反应属于交叉关系 | |
| C. | 复分解反应与中和反应属于包含关系 | |
| D. | 含氧化合物与氧化物属于并列关系 |
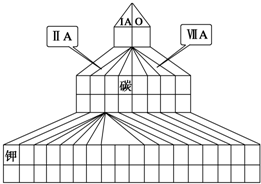 如图是元素周期表的另一种画法-塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:
如图是元素周期表的另一种画法-塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题: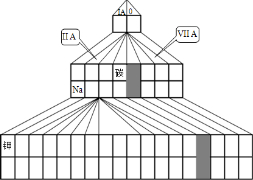
 或
或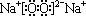
 化学与生活:防治环境污染,改善生态环境已成为全球的共识.
化学与生活:防治环境污染,改善生态环境已成为全球的共识.