题目内容
10.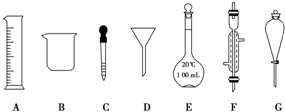 实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.
实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.(1)写出仪器名称:D漏斗,F冷凝管.
(2)下列实验操作中用到仪器G的是a(填下列选项的编号字母).
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(3)实验室需要配制450mL 0.4mol/L的硫酸溶液.
①配制时,实验室提供了以下仪器:烧杯、100mL量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是500mL容量瓶.上述实验中使用容量瓶前必须进行的操作是检验是否漏水
②配制该溶液需用98%的浓硫酸(密度为1.8g/mL)11.1mL.取用该体积浓硫酸时,需要用到上述仪器中的A和C(填仪器的编号字母).
③下列操作会使配制的溶液浓度偏高的是BDF(填下列选项的编号字母).
A.转移过程中有少量溶液溅出
B.没有冷却,立即转移到容量瓶中定容
C.摇匀后,液面下降,补充水
D.定容时俯视刻度线
F.量筒量取浓硫酸是仰视刻度线.
分析 (1)根据仪器的结构特点判断仪器的名称;
(2)G为分液漏斗,是用来分离互不相溶的液体;
(3)①依据配制一定物质的量浓度溶液步骤选择需要的仪器;依据配制溶液体积选择合适的容量瓶,依据容量瓶使用方法解答;
②依据C=$\frac{1000ρω}{M}$计算浓溶液物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓溶液的体积;
③分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)由仪器的图形可知:D为漏斗; F为冷凝管;
故答案为:漏斗;冷凝管;
(2)a.分离水和CCl4的混合物,二者都是液体,选择分液漏斗分离,故a正确;
b.分离水和酒精的混合物,二者相互溶解,不能使用分液漏斗分离,故b错误;
c.分离水和泥沙的混合物,应选择过滤方法分离,用到的仪器为漏斗,不是分液漏斗,故c错误;
故选:a;
(3)①配制一定物质的量浓度溶液步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,用到的仪器有:
量筒、烧杯、玻璃棒、容量瓶、胶头滴管,配制450mL 0.4mol/L的硫酸溶液,应选择500mL容量瓶,所以还缺少的仪器:500mL容量瓶;
容量瓶带有塞子,使用过程中需要上下颠倒,所以使用前需要检查是否漏水;
故答案为:500mL容量瓶,检验是否漏水;
②98%的浓硫酸(密度为1.8g/mL)物质的量浓度C=$\frac{1000×1.8×98%}{98}$=18mol/L,设需要浓硫酸体积为V,则依据稀释规律,18mol/L×V=0.4mol/L×0.5L,解得V=0.0011L,即11.1mL;用量筒量取浓溶液用到的仪器为量筒、胶头滴管;
故答案为:11.1; C;
③A.转移过程中有少量溶液溅出,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.没有冷却,立即转移到容量瓶中定容,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故选;
C.摇匀后,液面下降,补充水,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D选;
F.量筒量取浓硫酸是仰视刻度线,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高,故F选;
故选:BDF.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意误差分析的方法,题目难度不大.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案A.氟利昂 B.SO2C.NO2D.CO2
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |
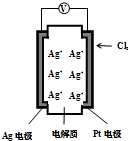 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| B. | Ag+向Pt电极移动 | |
| C. | 电子由Ag电极经外电路流向Pt电极 | |
| D. | Ag电极上发生了还原反应 |
| A. | 乙醇 | B. | 石墨 | C. | NH3 | D. | 熔融的NaCl |
 ;NH3的稳定性比PH3强(填写“强”或“弱”).
;NH3的稳定性比PH3强(填写“强”或“弱”).
 NH3•H2O
NH3•H2O NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;.
NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;.