题目内容
20.实验室可以用KClO3和50mL浓盐酸反应制取Cl2,反应原理如下:KClO3+HCl→KCl+Cl2↑+H2O(1)配平上述化学方程式并用单线桥标出电子转移方向与数目;
(2)浓盐酸在上述反应中表现出来的性质是C(填选项编号)
A.只有氧化性 B.只有还原性 C.还原性和酸性 D.氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为0.17mol(保留两位小数)
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物比还原产物多7.1g时,浓盐酸的物质的量浓度为12mol/L.
分析 (1)氧化还原反应中,化合价降低值=化合价升高值=转移电子数,根据化合价变化来确定电子转移方向和数目;
(2)盐酸在反应中部分转化为氯气,部分转化为氯化钾,据此回答;
(3)根据化合价升降结合方程式计算转移电子的物质的量;
(4)生成3mol氯气中,氧化产物是2.5molCl2比还原产物0.5mol多2mol,当氧化产物比还原产物比还原产物多7.1g即0.1mol时计算产生的氯气的量,根据c=$\frac{n}{V}$来计算.
解答 解:(1)该氧化还原反应中,氯酸钾中Cl元素化合价降低,盐酸中Cl元素化合价升高,化合价降低值=化合价升高值=转移电子数=5,电子转移方向和数目为: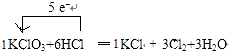 ,故答案为:
,故答案为: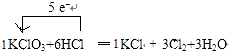 ;
;
(2)在氧化还原反应中,化合价升高Cl元素所在物质HCl在反应中被氧化,显示还原性,还有部分盐酸中元素化合价不变,生成了氯化钾,显示酸性,故选C;
(3)若产生3molCl2,则转移电子的物质的量为5mol,所以若产生0.1mol Cl2,则转移电子的物质的量为0.17mol,故答案为:0.17mol;
(4)生成3mol氯气中,氧化产物是2.5molCl2比还原产物0.5mol多2mol,当氧化产物比还原产物比还原产物多7.1g即0.1mol时,产生的氯气的量是0.15mol,消耗的盐酸的物质的量是0.3mol,反应中HCl的利用率只有50%,所以盐酸的物质的量是0.6mol,浓盐酸的物质的量浓度为$\frac{0.6mol}{0.05L}$=12mol/L,故答案为:12mol/L.
点评 本题考查根据方程式的计算、氧化还原反应有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
15.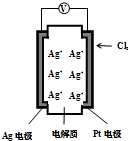 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| B. | Ag+向Pt电极移动 | |
| C. | 电子由Ag电极经外电路流向Pt电极 | |
| D. | Ag电极上发生了还原反应 |
5.将下列物质的溶液滴在相应的试纸上,试纸变色情况符合实际的是( )
| A. | SO2(蓝色石蕊试纸先变红后褪色) | B. | 氯水(pH试纸先变红后褪色) | ||
| C. | Na2S(pH试纸变红) | D. | KI(淀粉试纸变蓝) |
10.下列气体,可以用排水法收集的是( )
| A. | NO | B. | NH3 | C. | HCl | D. | Cl2 |

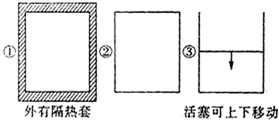 在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g)?2C(g)△H<0,若起始温度相同,分别向三个容器中充入6mol A和2mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③②①(填容器编号).
在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g)?2C(g)△H<0,若起始温度相同,分别向三个容器中充入6mol A和2mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③②①(填容器编号).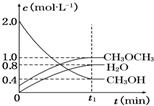 二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1.在T1℃时,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.
二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1.在T1℃时,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.