题目内容
【题目】如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
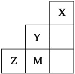
A.电负性:Z>M>Y
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为![]()
【答案】C
【解析】
图为元素周期表中短周期的一部分,由Y、Z、M在周期表中的位置关系可知,Y为F元素,M为Cl元素,Z为S元素;
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:Y>M>Z,故电负性Y>M>Z,故A错误;
B.电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大,离子半径:Z2->M->Y-,故B错误;
C.ZM2为SCl2,分子中S元素化合价为+2价,2+6=8,S原子满足8电子稳定结构,Cl元素化合价为-1价,|-1|+7=8,Cl原子满足8电子稳定结构,故C正确;
D.Z为S元素,最外层含有6个电子,其基态原子的最外层电子排布图为![]() ,故D错误;
,故D错误;
故答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】探究2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验 编号 | 温度 (℃) | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4 溶液褪色平均时间(min) | ||
体积 (mL) | 浓度 (mol·L-1) | 体积 (mL) | 浓度 (mol·L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈6.6×l0-3mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
【题目】要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
第二组 | NaOH | HCl | NaCl | Na2O | CO |
第三组 | NaOH | CH3COOH | CaSO4 | H2O2 | SO2 |
每组分类均有错误,其错误的物质分别是________、________、________(填化学式)。
(2)胶体和溶液的本质区别是______________;鉴别胶体和溶液所采用的方法是观察是否能发生______________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O![]() 4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
②2NaHCO3![]() Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
③Cl2+H2O![]() HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。
HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。