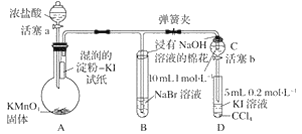
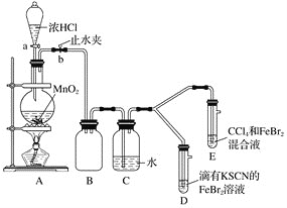
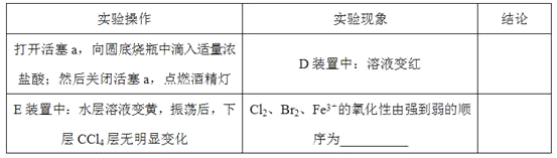
题目内容
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是( )
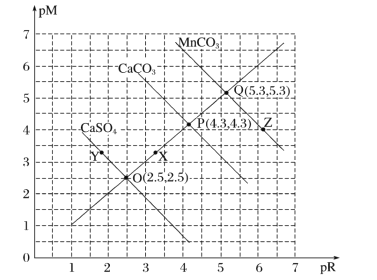
A.Y点:c(Ca2+)>c(SO42-),Z点:c(CO32-)>c(Mn2+)
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
【答案】D
【解析】
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,说明数值越大,对应的离子浓度越小;根据O、P、Q三点可求出MnCO3、CaCO3、CaSO4的Ksp值,即可比较溶解度大小;若Qc值大于Ksp,则有沉淀生成。
A.Y点pM大于3,pR小于3,则阴离子浓度大于阳离子浓度,即c(SO42-)>c(Ca2+);同理,Z点c(Mn2+)>c(CO32-),A项错误;
B.根据O、P、Q三点求MnCO3、CaCO3、CaSO4的Ksp值,![]() ;同理可得,Ksp(CaCO3)=10-8.6;Ksp(CaSO4)=10-5,故溶度积:Ksp(MnCO3)<Ksp(CaCO3)<Ksp(CaSO4),B项错误;
;同理可得,Ksp(CaCO3)=10-8.6;Ksp(CaSO4)=10-5,故溶度积:Ksp(MnCO3)<Ksp(CaCO3)<Ksp(CaSO4),B项错误;
C.横纵坐标分别为对应离子浓度的负对数,据图可知,X点的Qc值大于Ksp(CaCO3),有沉淀生成,不能再溶解CaCO3,C项错误;
D.T℃时,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常数K=
CaCO3(s)+SO42-(aq)的平衡常数K=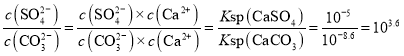 ,数量级为103,D项正确;
,数量级为103,D项正确;
答案选D。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目