题目内容
【题目】(一)已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是_____________(用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________。
A.c(H+) B.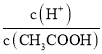 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.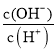 E.
E. ![]()
(3)向NaClO溶液中通入少量CO2,所发生反应的化学方程式为_____。
(二)在常温下,下列五种溶液:
①0.1molL﹣1NH4Cl溶液 ②0.1molL﹣1CH3COONH4溶液 ③0.1molL﹣1NH4HSO4溶液④0.1molL﹣1NH3H2O和0.1molL﹣1NH4Cl的混合溶液 ⑤0.1molL﹣1NH3H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是_____。(填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是②_____③(填“>”“<”或“=”)。
(3)在溶液④中,_____的浓度为0.1molL﹣1;NH3H2O和_____的物质的量浓度之和为0.2molL﹣1。
【答案】a<d<c<b BD ClO-+CO2+H2O═HClO+HCO3- ③ ⑤ < Cl- NH4+
【解析】
(一)(1)根据表格数据,酸性:CH3COOH>H2CO3>HClO>HCO3-。酸根离子对应酸的酸性越强,该离子的水解程度越小,溶液的pH越小;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓度减小,酸性减弱,结合温度不变,水的离子积常数不变,醋酸的电离平衡常数不变分析判断;
(3)酸性强弱HClO>HCO3-,书写二者反应的离子方程式;
(二)(1)五种0.1mol/L含NH4+的溶液,要考虑NH4+的水解以及H+、CH3COO-等条件对NH4+水解平衡的影响,依据另一种离子的影响分析判断;
(2)醋酸根离子水解促进铵根离子水解,NH4HSO4 溶液中的氢离子抑制铵根离子的水解;
(3)混合溶液中氯离子浓度不变为0.1mol/L;依据溶液中氮元素的物料守恒分析判断。
(一)(1)根据表格数据,酸性:CH3COOH>H2CO3>HClO>HCO3-。四种溶液的溶质都是强碱弱酸盐,物质的量浓度均为0.1 mol·L-1时,水解程度大小为:CO32->ClO->HCO3->CH3COO-,水解均显碱性,水解程度越大,碱性越强,所以碱性顺序是:Na2CO3>NaClO>NaHCO3>CH3COONa,即pH由小到大的排列顺序为:CH3COONa<NaHCO3<NaClO<Na2CO3,即:a<d<c<b,故答案为:a<d<c<b;
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱。
A、加水稀释醋酸,氢离子浓度减小,故A错误;
B、加水稀释醋酸过程中,促进醋酸的电离,氢离子物质的量增大,醋酸分子物质的量减小,所以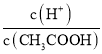 增大,故B正确;
增大,故B正确;
C、温度不变,水的离子积常数不变,故C错误;
D、醋酸溶液加水稀释时,酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,所以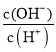 增大,故D正确;
增大,故D正确;
E、温度不变,醋酸的电离平衡常数不变,即![]() 不变,故E错误;
不变,故E错误;
故答案为:BD;
(3)酸性强弱HClO>HCO3-,根据强酸制取弱酸,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故答案为:ClO-+CO2+H2O═HClO+HCO3-;
(二)(1)以①0.1mol/L NH4Cl中铵根离子浓度略小于0.1mol/L为标准;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,溶液显酸性;④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;⑤0.1mol/L NH3H2O,一水合氨是弱碱存在电离平衡,电离程度较小,溶液中铵根离子浓度远小于0.1mol/L,小于①,溶液呈碱性;所以溶液pH最小的是③,铵根离子浓度最小的是⑤,故答案为:③;⑤;
(2)根据(1)的分析,②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,c(NH4+):②<③,故答案为:<;
(3)④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液中,氯离子浓度不变为0.1mol/L;根据氮元素守恒得到NH3H2O和NH4+浓度为0.2mol/L,故答案为:Cl-;NH4+。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应