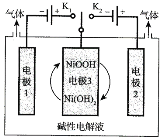
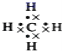ƒøƒ⁄»ð
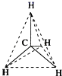
°æƒø°øA°¢B°¢C°¢D°¢E «∫ÀµÁ∫… ˝“¿¥Œ‘ˆ¥ÛµƒŒÂ÷÷∂Ã÷Ð∆⁄÷˜◊‘™Àÿ£¨A‘≠◊”∫Àƒ⁄÷ª”–1∏ˆ÷ ◊”£ªB‘≠◊”∞Îæ∂ «∆‰À˘‘⁄÷˜◊Â÷–◊Ó–°µƒ£¨Bµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶µƒÀƪ،ԵƒªØ—ß ΩŒ™HBO3£ªC‘≠◊”◊ÓÕ‚≤„µƒµÁ◊” ˝±»¥ŒÕ‚≤„µƒ∂ý4£ªCµƒºÚµ•“ı¿Î◊””ÎDµƒ—Ù¿Î◊”æþ”–œýÕ¨µƒµÁ◊”≤„Ω·ππ£¨¡Ω‘™Àÿø…–Œ≥…ªØ∫œŒÔD2C£ªC°¢EÕ¨÷˜◊°£ªÿ¥œ¬¡–Œ £∫
(1)B‘⁄‘™Àÿ÷Ð∆⁄±Ì÷–µƒŒª÷√Œ™______________________°£
(2)B°¢C°¢D°¢E–Œ≥…µƒºÚµ•¿Î◊”∞Îæ∂”…¥ÛµΩ–°µƒπÿœµ «________________(”√¿Î◊”∑˚∫≈±Ì æ)°£
(3)”√µÁ◊” Ω±Ì æªØ∫œŒÔD2Cµƒ–Œ≥…π˝≥Ã______________________°£
(4)”…A°¢B°¢C»˝÷÷‘™Àÿ–Œ≥…µƒ≥£º˚µƒ¿Î◊”ªØ∫œŒÔµƒªØ—ß ΩŒ™___________£¨∏√ªØ∫œŒÔµƒÀƻГ∫÷–∏˜¿Î◊”µƒ≈®∂»”…¥ÛµΩ–°µƒÀ≥–ÚŒ™______________________°£
(5)ªØ∫œŒÔD2EC3‘⁄“ª∂®Ãıº˛œ¬ø…“‘∑¢…˙∑÷Ω‚∑¥”¶…˙≥…¡Ω÷÷—Œ£¨∆‰÷–“ª÷÷≤˙ŒÔŒ™ŒÞ—ıÀ·—Œ£¨‘Ú¥À∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™______________________°£
°æ¥∞∏°øµ⁄∂˛÷Ð∆⁄µ⁄¢ıA◊ S2-£æN3-£æO2-£æNa+ ![]() NH4NO3 c(NO3-) £æ c(NH4+)£æ c(H+)£æ c(OH-) 4Na2SO3
NH4NO3 c(NO3-) £æ c(NH4+)£æ c(H+)£æ c(OH-) 4Na2SO3![]() Na2S+ 3Na2SO4
Na2S+ 3Na2SO4
°æΩ‚Œˆ°ø
A°¢B°¢C°¢D°¢E «∫ÀµÁ∫… ˝“¿¥Œ‘ˆ¥ÛµƒŒÂ÷÷∂Ã÷Ð∆⁄÷˜◊‘™Àÿ£¨A‘™Àÿµƒ‘≠◊”∫Àƒ⁄÷ª”–1∏ˆ÷ ◊”£¨‘ÚAŒ™H‘™Àÿ£ªB‘™Àÿµƒ‘≠◊”∞Îæ∂ «∆‰À˘‘⁄÷˜◊Â÷–◊Ó–°µƒ£¨¥¶”⁄µ⁄∂˛÷Ð∆⁄£¨Bµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶Àƪ،ԵƒªØ—ß ΩŒ™HBO3£¨B‘™Àÿ◊Ó∏þ’˝º€Œ™+5£¨π BŒ™N‘™Àÿ£ªC‘™Àÿ‘≠◊”µƒ◊ÓÕ‚≤„µÁ◊” ˝±»¥ŒÕ‚≤„∂ý4∏ˆ£¨‘≠◊”÷ªƒÐ”–2∏ˆµÁ◊”≤„£¨◊ÓÕ‚≤„µÁ◊” ˝Œ™6£¨π CŒ™O‘™Àÿ£ªCµƒ“ı¿Î◊””ÎDµƒ—Ù¿Î◊”æþ”–œýÕ¨µƒµÁ◊”≈≈≤º£¨¿Î◊”∫ÀÕ‚µÁ◊” ˝Œ™10£¨¡Ω‘™Àÿø…–Œ≥…ªØ∫œŒÔD2C£¨D‘™ÀÿªØ∫œº€Œ™+1£¨¥¶”⁄IA◊£¨π DŒ™Na£ªC°¢EÕ¨÷˜◊£¨‘ÚEŒ™S‘™Àÿ£¨æð¥ÀΩ‚¥°£
(1)BŒ™N‘™Àÿ£¨‘≠◊”∫ÀÕ‚”–2∏ˆµÁ◊”≤„£¨◊ÓÕ‚≤„µÁ◊” ˝Œ™5£¨‘ÚŒª”⁄÷Ð∆⁄±Ì÷–µ⁄∂˛÷Ð∆⁄¢ıA◊£ª
(2)‘™ÀÿB°¢C°¢D°¢E–Œ≥…µƒ¿Î◊”∑÷±Œ™N3-°¢O2-°¢Na+°¢S2-£¨S2-¿Î◊”∫ÀÕ‚”–3∏ˆµÁ◊”≤„£¨¿Î◊”∞Îæ∂◊Ó¥Û£¨N3-£¨O2-”ÎNa+¿Î◊”∫ÀÕ‚µÁ◊”≈≈≤ºœýÕ¨£¨∂º”–2∏ˆµÁ◊”≤„£¨∫ÀµÁ∫À ˝‘Ω¥Û£¨¿Î◊”∞Îæ∂‘Ω–°£¨‘Ú¿Î◊”∞Îæ∂N3-£æO2-£æNa+£ª
(3)ªØ∫œŒÔD2CŒ™Na2O£¨Œ™¿Î◊”ªØ∫œŒÔ£¨”√µÁ◊” Ω±Ì æµƒ–Œ≥…π˝≥ÃŒ™![]() £ª
£ª
(4)”…A°¢B°¢C»˝÷÷‘™Àÿ–Œ≥…µƒ—ŒŒ™NH4NO3£¨NH4NO3µƒÀƻГ∫÷–NH4+ÀÆΩ‚ π»Ð“∫œ‘À·–‘£¨‘ڻГ∫÷–∏˜¿Î◊”µƒ≈®∂»”…¥ÛµΩ–°µƒÀ≥–ÚŒ™c(NO3-) £æ c(NH4+)£æ c(H+)£æc(OH-)£ª
(5)ªØ∫œŒÔD2EC3Œ™Na2SO3£¨‘⁄“ª∂®Ãıº˛œ¬ø…“‘∑¢…˙∑÷Ω‚∑¥”¶…˙≥…¡Ω÷÷—Œ£¨∆‰÷–“ª÷÷≤˙ŒÔŒ™ŒÞ—ıÀ·—Œ£¨”¶Œ™Na2S£¨”…—ıªØªπ‘≠∑¥”¶µƒµÁ◊” ÿ∫„πʬ…£¨¡Ì“ª÷÷≤˙ŒÔ”¶Œ™Na2SO4£¨π ∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™4Na2SO3![]() Na2S+3Na2SO4°£
Na2S+3Na2SO4°£

 —ß∂¯”≈ Ó∆⁄œŒΩ”ƒœæ©¥Û—ß≥ˆ∞Ê…Áœµ¡–¥∞∏
—ß∂¯”≈ Ó∆⁄œŒΩ”ƒœæ©¥Û—ß≥ˆ∞Ê…Áœµ¡–¥∞∏ Happy holidayª∂¿÷ºŸ∆⁄ ÓºŸ◊˜“µπ„∂´»À√Ò≥ˆ∞Ê…Áœµ¡–¥∞∏
Happy holidayª∂¿÷ºŸ∆⁄ ÓºŸ◊˜“µπ„∂´»À√Ò≥ˆ∞Ê…Áœµ¡–¥∞∏°æƒø°ø¡Ú∫Õµ™µƒ—ıªØŒÔ÷±Ω”≈≈∑≈ª·“˝∑¢—œ÷ÿµƒª∑æ≥Œ £¨«Îªÿ¥œ¬¡–Œ £∫
(1)œ¬¡–ª∑æ≥Œ Â÷˜“™”…¡Ú—ıªØŒÔ∫Õµ™—ıªØŒÔµƒ≈≈∑≈“˝∑¢µƒ «___________°£
A.»´«Ú±‰≈Ø B.À·”Í C.ÀÆÃÂ∏ª”™—¯ªØ(Àƪ™) D.∞◊…´Œ€»æ
(2)SO2µƒ≈≈∑≈÷˜“™¿¥◊‘”⁄√∫µƒ»º…’°£≥£”√ ت“ ØÕ—¡Ú£¨∆‰≤˙ŒÔø…“‘◊ˆΩ®÷˛≤ƒ¡œ°£
“—÷™£∫CaCO3(s)=CO2(g)+CaO(s) ¶§H=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ¶§H=£≠402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ¶§H=£≠234.2kJ/mol
–¥≥ˆCaCO3”ÎSO2Õ—¡Úµƒ»»ªØ—ß∑¥”¶∑Ω≥à Ω_____________________________________°£
(3)NOxµƒ≈≈∑≈÷˜“™¿¥◊‘”⁄∆˚≥µŒ≤∆¯£¨∞¸∫¨NO2∫ÕNO£¨”–»À÷≥ˆ”√ªÓ–‘Ãø∂‘NOxΩ¯––Œ¸∏Ω£¨∑¢…˙∑¥”¶»Áœ¬£∫
∑¥”¶a£∫C(s)+2NO(g)![]() N2(g)+CO2(g) ¶§H=£≠34.0kJ/mol
N2(g)+CO2(g) ¶§H=£≠34.0kJ/mol
∑¥”¶b£∫2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ¶§H=£≠64.2kJ/mol
N2(g)+2CO2(g) ¶§H=£≠64.2kJ/mol
∂‘”⁄∑¥”¶a£¨‘⁄T1°Ê ±£¨ΩË÷˙¥´∏–∆˜≤‚µ√∑¥”¶‘⁄≤ªÕ¨ ±º‰µ„…œ∏˜ŒÔ÷ µƒ≈®∂»»Á±Ì£∫
≈®∂»(molL-1) | ±º‰(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
¢Ÿ0~10minƒ⁄£¨NOµƒ∆Ωæ˘∑¥”¶ÀŸ¬ v(NO)=___________£¨µ±…˝∏þ∑¥”¶Œ¬∂»£¨∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝K___________(—°ÃÓ°∞‘ˆ¥Û°±°¢°∞ºı–°°±ªÚ°∞≤ª±‰°±)°£
¢⁄30min∫Û£¨÷ª∏ƒ±‰ƒ≥“ªÃıº˛£¨∑¥”¶÷ÿ–¬¥ÔµΩ∆Ω∫‚£ª∏˘æð…œ±Ì÷–µƒ ˝æð≈–∂œ∏ƒ±‰µƒÃıº˛ø…ƒÐ «___________(ÃÓ◊÷ƒ∏)°£
A.º”»Î“ª∂®¡øµƒªÓ–‘Ãø B.Õ®»Î“ª∂®¡øµƒNO
C. µ±Àı–°»ð∆˜µƒÃª˝ D.º”»Î∫œ µƒ¥þªØº¡
(4)ƒ≥ µ—È “ƒ£ƒ‚∑¥”¶b£¨‘⁄∫„—π√б’»ð∆˜÷–º”»Î◊„¡øµƒªÓ–‘Ãø∫Õ“ª∂®¡øµƒNO∆¯Ã£¨≤‚µ√NOµƒ◊™ªØ¬ ¶¡(NO)ÀÊŒ¬∂»µƒ±‰ªØ»ÁÕºÀ˘ æ£∫
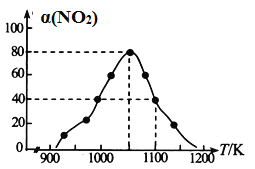
¢⁄”√ƒ≥ŒÔ÷ µƒ∆Ω∫‚∑÷—π¥˙ÃÊ∆‰ŒÔ÷ µƒ¡ø≈®∂»“≤ø…“‘±Ì æªØ—ß∆Ω∫‚≥£ ˝(º«◊˜Kp)°£‘⁄1050K°¢1.1°¡106Pa ±£¨∏√∑¥”¶µƒªØ—ß∆Ω∫‚≥£ ˝Kp£Ω________(÷ª¡–≥ˆº∆À„ Ω)(“—÷™£∫∆¯ÃÂ∑÷—π£Ω∆¯ÃÂ◊Зπ°¡Ãª˝∑÷ ˝)°£
°æƒø°ø(“ª)“—÷™25 °Ê ±≤ø∑÷»ıµÁΩ‚÷ µƒµÁ¿Î∆Ω∫‚≥£ ˝ ˝æð»Á±ÌÀ˘ æ£∫
ªØ—ß Ω | CH3COOH | H2CO3 | HClO |
µÁ¿Î∆Ω∫‚≥£ ˝ | Ka£Ω1.8°¡10£≠5 | Ka1£Ω4.3°¡10£≠7 Ka2£Ω5.6°¡10£≠11 | Ka£Ω3.0°¡10£≠8 |
ªÿ¥œ¬¡–Œ £∫
£®1£©ŒÔ÷ µƒ¡ø≈®∂»æ˘Œ™0.1 mol°§L£≠1µƒÀƒ÷÷»Ð“∫£∫
a£ÆCH3COONa °°b£ÆNa2CO3°° c£ÆNaClO°° d£ÆNaHCO3
pH”…–°µΩ¥Û≈≈¡–À≥–Ú «_____________(”√±ý∫≈ÃÓ–¥)°£
£®2£©≥£Œ¬œ¬£¨0.1 mol/LµƒCH3COOH»Ð“∫º”ÀÆœ° Õπ˝≥Ã÷–£¨œ¬¡–±Ì¥Ô Ωµƒ ˝æ𱉥۵ƒ «________°£
A£Æc(H£´) B£Æ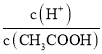 C£Æc(H£´)°§c(OH£≠) D£Æ
C£Æc(H£´)°§c(OH£≠) D£Æ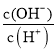 E£Æ
E£Æ ![]()
£®3£©œÚNaClO»Ð“∫÷–Õ®»Î…Ÿ¡øCO2£¨À˘∑¢…˙∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™_____°£
(∂˛)‘⁄≥£Œ¬œ¬£¨œ¬¡–ŒÂ÷÷»Ð“∫£∫
¢Ÿ0.1molL©Å1NH4Cl»Ð“∫°°¢⁄0.1molL©Å1CH3COONH4»Ð“∫°°¢€0.1molL©Å1NH4HSO4»Ð“∫¢Ð0.1molL©Å1NH3H2O∫Õ0.1molL©Å1NH4ClµƒªÏ∫œ»Ð“∫°°¢ð0.1molL©Å1NH3H2O»Ð“∫
«Î∏˘æð“™«ÛÃÓ–¥œ¬¡–ø’∞◊£∫
£®1£©‘⁄…œ ˆŒÂ÷÷»Ð“∫÷–£¨pH◊Ó–°µƒ «_____£ªc£®NH4+£©◊Ó–°µƒ «_____°££®ÃÓ–Ú∫≈£©
£®2£©±»Ωœ»Ð“∫¢⁄°¢¢€÷–c£®NH4+£©µƒ¥Û–°πÿœµ «¢⁄_____¢€£®ÃÓ°∞£æ°±°∞£º°±ªÚ°∞£Ω°±£©°£
£®3£©‘⁄»Ð“∫¢Ð÷–£¨_____µƒ≈®∂»Œ™0.1molL©Å1£ªNH3H2O∫Õ_____µƒŒÔ÷ µƒ¡ø≈®∂»÷Æ∫ÕŒ™0.2molL©Å1°£