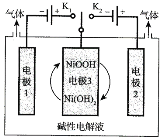
题目内容
【题目】如图是NaCl晶体的一个晶胞的结构模型(黑球为Cl-、白球为Na+)。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述不正确的是( )
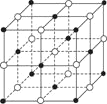
A.与K+距离相等且最近的K+有8个
B.与K+距离相等且最近的O2-构成的多面体是正八面体
C.一个KO2晶胞中的K+和O2-粒子数均为4个
D.与K+距离相等且最近的O2-共有6个
【答案】A
【解析】
A.K+位于晶胞棱心,被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4![]() 3= 12个,A错误;
3= 12个,A错误;
B.与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,B正确;
C.K+位于晶胞棱心和体心,平均每个晶胞的数目为![]() ,O2-位于顶点和面心,平均每个晶胞的数目为
,O2-位于顶点和面心,平均每个晶胞的数目为![]() ,即一个KO2晶胞中分摊得的K+和O2-粒子数均为4个,C正确;
,即一个KO2晶胞中分摊得的K+和O2-粒子数均为4个,C正确;
D.K+位于晶胞棱心,与K+距离相等且最近的O2-位于顶点和面心,共有6个,D正确;
故选A。

【题目】(一)已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是_____________(用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________。
A.c(H+) B.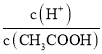 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.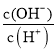 E.
E. ![]()
(3)向NaClO溶液中通入少量CO2,所发生反应的化学方程式为_____。
(二)在常温下,下列五种溶液:
①0.1molL﹣1NH4Cl溶液 ②0.1molL﹣1CH3COONH4溶液 ③0.1molL﹣1NH4HSO4溶液④0.1molL﹣1NH3H2O和0.1molL﹣1NH4Cl的混合溶液 ⑤0.1molL﹣1NH3H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是_____。(填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是②_____③(填“>”“<”或“=”)。
(3)在溶液④中,_____的浓度为0.1molL﹣1;NH3H2O和_____的物质的量浓度之和为0.2molL﹣1。
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等