题目内容
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
【答案】A
【解析】
A、Kw=c(H+)×c(OH-),c(H+)=![]() ,说明c(H+)=c(OH-),所以溶液一定呈中性,A项正确;
,说明c(H+)=c(OH-),所以溶液一定呈中性,A项正确;
B、水的电离为吸热反应,加热促进电离,KW增大,c(H+)增大,则pH减小,但仍呈中性,B项错误;
C、Kw只与温度有关,C项错误;
D、酸电离出来的氢离子能抑制水电离,向0.1 molL-1醋酸溶液中加水,酸的浓度减小,则溶液中水电离产生的c(H+) 将增大,D项错误;
答案选A。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式_____________________________________。
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
浓度(molL-1) | 时间(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
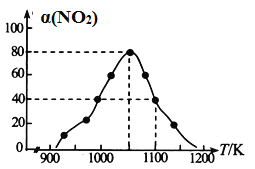
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(只列出计算式)(已知:气体分压=气体总压×体积分数)。
【题目】(一)已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是_____________(用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________。
A.c(H+) B.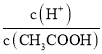 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.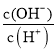 E.
E. ![]()
(3)向NaClO溶液中通入少量CO2,所发生反应的化学方程式为_____。
(二)在常温下,下列五种溶液:
①0.1molL﹣1NH4Cl溶液 ②0.1molL﹣1CH3COONH4溶液 ③0.1molL﹣1NH4HSO4溶液④0.1molL﹣1NH3H2O和0.1molL﹣1NH4Cl的混合溶液 ⑤0.1molL﹣1NH3H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是_____。(填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是②_____③(填“>”“<”或“=”)。
(3)在溶液④中,_____的浓度为0.1molL﹣1;NH3H2O和_____的物质的量浓度之和为0.2molL﹣1。
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等