题目内容
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 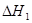 ="-443.64" kJ·mol-1
="-443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g) 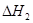 = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)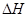 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |
D
解析试题分析:A、1mol物质燃烧的反应热为燃烧热,所以CO的燃烧热为283.0kJ/mol,错误;B、因为CO与O2的反应为放热反应,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,错误;D、根据盖斯定律,2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)的?H=2?H1+?H2=" -1453.28" kJ·mol-1,正确;C、由C项中的热化学方程式可知完全燃烧20g甲醇放出的热量为:20g÷32g/mol÷2×1453.28 kJ·mol-1=454.15kJ,错误。
考点:本题考查盖斯定律、热化学方程式的书写、燃烧热的含义。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案已知反应X+Y=M+N 为放热反应,对该反应的下列说法中正确的是( )
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
下列热化学方程式书写正确的是(△H的绝对值均为正确值)
| A.2NO2=O2+2NO△H=+116.2 kJ/mol(反应热) |
| B.S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol(反应热) |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kJ/mol(中和热) |
| D.C2H5OH(l)+2O2(g)=2CO (g)+3H2O(g)△H=-801 kJ/mol(燃烧热) |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+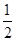 O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6 kJ/mol |
C.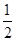 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
白磷与氧可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是( )
H,其中正确的是( )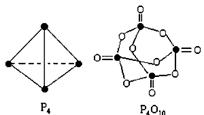
| A.(6a+5d-4c-12b) kJ·mol-1 | B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 | D.(4a+5d-4c-12b) kJ·mol-1 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═ CO2(g)+2H2O(g)△H = -890.3kJ/mol |
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H =-38.6kJ/mol 2NH3(g)△H =-38.6kJ/mol |
| C.在l01lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H =-571.6kJ/mol |
| D.HCI和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2:反应的中和热△H = 2×(-57.3)kJ/mol |
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )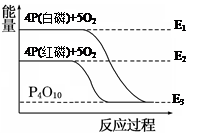
| A.白磷比红磷稳定 |
| B.白磷燃烧是吸热反应 |
| C.红磷转变为白磷是吸热反应 |
| D.红磷燃烧的热化学方程式:4P(s) + 5O2(g)=P4O10(s) ΔH=(E2-E3)kJ/mol |