题目内容
白磷与氧可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是( )
H,其中正确的是( )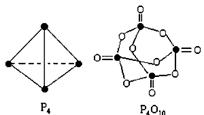
| A.(6a+5d-4c-12b) kJ·mol-1 | B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 | D.(4a+5d-4c-12b) kJ·mol-1 |
A
解析试题分析:化学反应的实质是反应物原有化学键的断裂和生成物新化学键生成的过程,依据键能的数值可以估算化学反应的热效应,ΔH=反应物的键能总和-生成物的键能总和= (6a+5d-4c-12b) kJ·mol-1,故A项正确。
考点:本题考查根据键能计算?H。

已知下列热化学方程式,则③中的Q3值为
Zn(s)+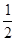 O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
Hg(l) +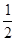 O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ? mol-1 ③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |
已知:
(1)Fe2O3(s) + C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+ O2(g)=Fe2O3(s) 的ΔH是( )
O2(g)=Fe2O3(s) 的ΔH是( )
| A.-824.4 kJ/mol | B.-627.6 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 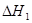 ="-443.64" kJ·mol-1
="-443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g) 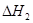 = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)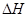 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
下列说法或表示方法正确的是( )
| A.已知C(s)+O2(g)=CO2(g) ΔH1,C(s)+1/2O2(g)="CO(g)" ΔH2;则ΔH1>ΔH2 |
| B.等量的H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| D.由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH >0 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示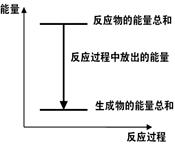 |
| B.ΔH的值与反应方程式的计量系数有关 |
| C.若将该反应设计成原电池则锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
下列图示与对应的叙述相符的是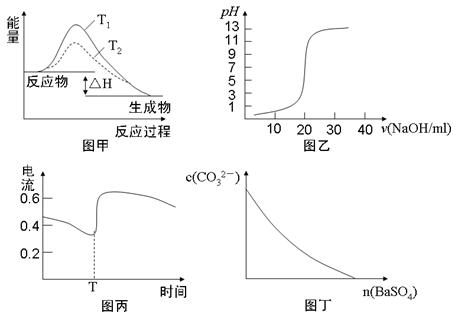
| A.图甲表示T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
| D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
 2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是