题目内容
下列热化学方程式中,正确的是
| A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═ CO2(g)+2H2O(g)△H = -890.3kJ/mol |
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H =-38.6kJ/mol 2NH3(g)△H =-38.6kJ/mol |
| C.在l01lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H =-571.6kJ/mol |
| D.HCI和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2:反应的中和热△H = 2×(-57.3)kJ/mol |
C
解析试题分析:A燃烧热是1mol的物质完全燃烧生成稳定的氧化物时放出的热。对甲烷来说气态的水是不稳定的,错误。B该反应是可逆反应,0.5mol N2和1.5m01H2在密闭容器中不能完全反应,所以△H <-38.6kJ/mol ,错误。C符合热反应方程式的书写,能量也与物质相对应,正确。D中和热是酸与碱反应生成1mol水时放出的热量。它跟生成的水的量的多少无关,错误。
考点:考查燃烧热、中和热的概念及相应的热化学方程式的书写等的知识。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列有关能量转换的说法正确的是( )
| A.煤燃烧是化学能全部转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 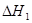 ="-443.64" kJ·mol-1
="-443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g) 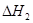 = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)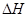 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |
下列说法或表示方法正确的是( )
| A.已知C(s)+O2(g)=CO2(g) ΔH1,C(s)+1/2O2(g)="CO(g)" ΔH2;则ΔH1>ΔH2 |
| B.等量的H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| D.由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH >0 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示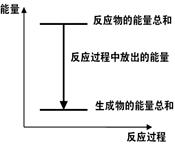 |
| B.ΔH的值与反应方程式的计量系数有关 |
| C.若将该反应设计成原电池则锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
已知:25℃、l0lkPa条件下
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9kJ/mol
4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.91kJ/mol: 由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
CO(g)+H2O(g) H2(g)+CO2(g)<0,在其他条件不变的情况下:
H2(g)+CO2(g)<0,在其他条件不变的情况下:
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
下列图示与对应的叙述相符的是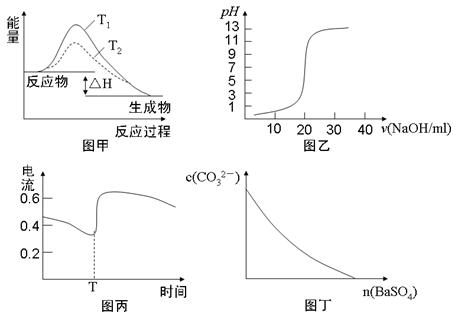
| A.图甲表示T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
| D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |