��Ŀ����
����Ŀ���ش���������
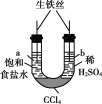
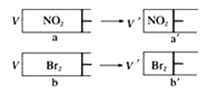
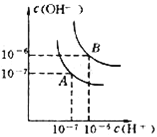
��1����pH���������������ҺA�����ᣩ��B��CH3COOH���քe��п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ����_____����д��ţ���
�ٿ�ʼ��Ӧʱ������A��B �ڲμӷ�Ӧ��п�����ʵ���A=B
�۷�Ӧ����Ҫ��ʱ��B��A ��A����пʣ��
��2����֪��CH3COOH�dz��������ᣬ���г�����0.1molL-1��CH3COOH��Һ��
���¶Ȳ��䣬��ˮϡ�����У����б���ʽ������һ����С����_____������ĸ��ţ���ͬ������������Һ�����¶ȣ����б���ʽ�������������_____��
A��c(H+) B��c(H+)��c(OH-)
C��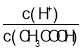 D��
D��![]()
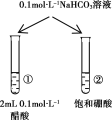
��3��ȡ0.10mol CH3COOH�������ᣩ��������ʵ�飬����䵼����������ˮ���仯��ͼ��ʾ���Ƚ�a��b���������ʣ�������������������=������
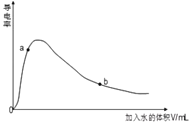
�� n(H+)��a_____b��
�� c(CH3COO-)��a_____b��
����ȫ�к�ʱ����NaOH�����ʵ�����a_____b��
��4��25��ʱ���������ʵĵ���ƽ�ⳣ�����±���ʾ��
CH3COOH | H2CO3 | HCN |
1.7��10��5 | K1=4.3��10-7 K2=5.6��10��11 | 4.9��10��10 |
��ش��������⣺
�� CH3COOH��H2CO3��HCN��������ǿ������˳��Ϊ_________��
�� ��¯ú����һ�㺬��H2S��HCN���壬�еĹ�������������£�ʹ��K2CO3��Һ����ú���е�H2S��HCN���壬ʵ���������衣������������ݣ����Դ��������Ʋ�ͬΪ0.l molL-1��K2CO3��Һ��HCN��Ϻ�����ܷ����ķ�Ӧ�����ӷ���ʽ_____��
���𰸡��ڢ� A ABCD �� �� = CH3COOH��H2CO3��HCN CO32- + HCN ![]() HCO3- + CN-
HCO3- + CN-
��������
��1����pH������ʹ�����Һ��������Ũ����ͬ�������Ũ��С��CH3COOH��Ũ�ȣ��������ȣ�����������ʵ�������������ʵ����࣬����п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�����������ͬ���õ�п�����ᷴӦ����㣬п����ᷴӦп���㣻
��2�����¶Ȳ��䣬��ˮϡ�����У�ƽ������뷽���ƶ���CH3COOH��Һ��c(H+)��c(CH3COO-)��c(CH3COOH)����С���¶Ȳ��䣬ˮ�����ӻ������ʹ�����볣�����䣻
�ڴ����ˮ�ĵ������Ϊ���ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)��c(CH3COO-)����c(CH3COOH)��С��ˮ�����ӻ������ʹ�����볣������
��3�������ǹ��ۻ����Һ̬�����в����������ƶ������ӣ�����Ϊ���ᣬ��ˮϡ�ͣ�ƽ������뷽���ƶ���
��4������ƽ�ⳣ��Խ������Խǿ��
��1���ٵ�pH������ʹ�����Һ��������Ũ����ͬ����ʼ��Ӧʱ��������ȣ��ʢٴ���
�ڷų�������������ͬ���ɵ�ʧ������Ŀ�غ��֪�μӷ�Ӧ��п�����ʵ�����ȣ��ʢ���ȷ��
���������Һ�д��ڵ���ƽ�⣬��pH������ʹ�����Һ��п��Ӧʱ��������Һ��������Ũ�ȱ仯С��������Ũ��Խ��Ӧ����Խ�죬���ɵ�����������ʱ��Խ�٣��ʢ۴���
�ܵ�pH������ʹ�����Һ�������Ũ��С��CH3COOH��Ũ�ȣ��������ȣ�����������ʵ�������������ʵ����࣬����п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�����������ͬ���õ�п�����ᷴӦ����㣬п����ᷴӦп���㣬�ʢ���ȷ��
�ʴ�Ϊ�ڢܣ�
��2�����¶Ȳ��䣬��ˮϡ�����У�ƽ������뷽���ƶ���CH3COOH��Һ��c(H+)��c(CH3COO-)��c(CH3COOH)����С���¶Ȳ��䣬ˮ�����ӻ������ʹ�����볣�����䡣
A����ˮϡ�����У�c��H+����С����A��ȷ��
B����ˮϡ�����У�ˮ�����ӻ�����Kw= c(H+)��c(OH-)���䣬��B����
C��������볣��K=![]() ����Һ��
����Һ��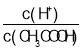 =
=![]() ����ˮϡ�����У�K���䣬c(CH3COO-)��С����
����ˮϡ�����У�K���䣬c(CH3COO-)��С����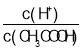 ����C����
����C����
D����ˮϡ�����У�������볣��K=![]() ���䣬��D����
���䣬��D����
�ʴ�ΪA��
�ڴ����ˮ�ĵ������Ϊ���ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)��c(CH3COO-)����c(CH3COOH)��С��ˮ�����ӻ������ʹ�����볣������
A�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)����A��ȷ��
B�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���ˮ�����ӻ�����Kw= c(H+)��c(OH-)����B��ȷ��
C�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)����c(CH3COOH)��С����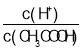 ����C��ȷ��
����C��ȷ��
D�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���������볣��K=![]() ����D��ȷ��
����D��ȷ��
�ʴ�ΪABCD��
��3���ٴ���Ϊ���ᣬ��ˮϡ�ͣ�ƽ������뷽���ƶ���n(H+)������a��b���ʴ�Ϊ����
�ڴ���Ϊ���ᣬ��ˮϡ�ͣ�ƽ������뷽���ƶ���n(CH3COO-)����c(CH3COO-)��������С����ͼ��֪a��b���ʴ�Ϊ����
����Һϡ��ǰ�����ʵ����ʵ������䣬����ȫ�к�ʱ����NaOH�����ʵ�����ȣ��ʴ�Ϊ=��
��4���ٸ��ݱ������ݿ�֪����ĵ����ƽ�ⳣ����СΪCH3COOH��H2CO3��HCN��HCO3-������ƽ�ⳣ��Խ������Խǿ����������ǿ������˳��ΪCH3COOH��H2CO3��HCN���ʴ�ΪCH3COOH��H2CO3��HCN��
�ڸ��ݱ������ݿ�֪��������ǿ������˳��ΪCH3COOH��H2CO3��HCN��HCO3-����ǿ���������ԭ����֪��K2CO3��Һ��HCN��Ӧ����KCN��KHCO3����Ӧ�����ӷ���ʽΪCO32- + HCN![]() HCO3- + CN-���ʴ�ΪCO32- + HCN
HCO3- + CN-���ʴ�ΪCO32- + HCN![]() HCO3- + CN-��
HCO3- + CN-��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д�����Ŀ������ʵ���������������Ӧ���ǣ� ��
A | B | C | D | |
ʵ�� |
|
|
|
|
���� | һ��ʱ���a��Һ�����b��Һ�� | ����KMnO4��Һ��ɫ | pH�Ʋ�â���pH���ڢ���pH | �Թܢ����д������ݣ��Թܢ��������� |
���� | a�ܷ���������ʴ��b�ܷ������ⸯʴ | ����ϩ���ɿ���ʹ����KMnO4��Һ��ɫ | �����ԣ�Mg��Al | ���ԣ����̼����� |
A.AB.BC.CD.D