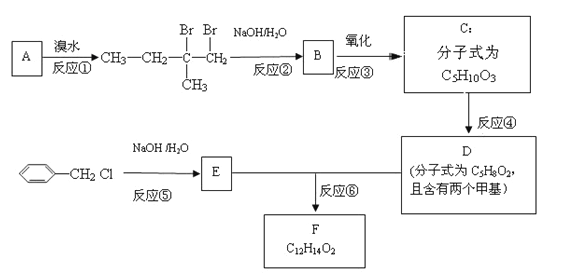
题目内容
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A. 各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C. 冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小
D. NaHCO3和Na2CO3混合溶液中,一定有2c(Na+)=3〔c(H2CO3)+c(HCO![]() )+c(CO
)+c(CO![]() )〕
)〕
【答案】A
【解析】A、根据表中酸的电离平衡常数,可以知道酸性顺序是:醋酸>氢氰酸>碳酸氢根,盐的水解规律:越弱越水解,所以水解能力:碳酸钠>氰化钠>醋酸钠,即pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A正确;B.a molL-1HCN溶液与b molL-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),根据电荷守恒得c(OH-)>c(H+),溶液呈碱性,溶液中的溶质可能是氰化钠或氰化钠和少量HCN或氰化钠和NaOH,a、b的关系不确定,故B错误;C.加水稀释冰醋酸,促进醋酸电离,离子浓度先增大,增大到一定程度时再加水稀释,离子浓度反而减小,所以溶液的导电性先增大后减小,溶液的pH先减小后增大,故C错误;D.只有Na2CO3和NaHCO3等物质的量混合,才存在2c(Na+)=3〔c(H2CO3)+c(HCO3-)+c(CO32-)〕,故D错误;故选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目