题目内容
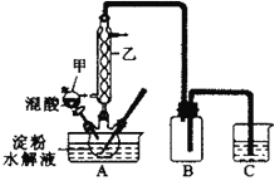
【题目】海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为
微粒种类 | Cl- | Na+ | Mg2+ |
| Ca2+ |
微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |
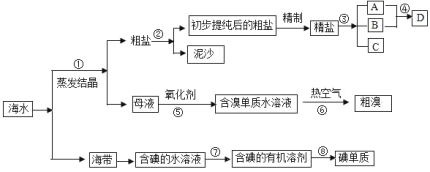
请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、![]() 等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________(填“能”或“不能”)用![]() 一种试剂替代步骤②中两种试剂,理由是________。
一种试剂替代步骤②中两种试剂,理由是________。
【答案】过滤 导气管 Cl2+2OH-=Cl-+ClO-+H2O becad 能 Mg2+、SO42-均可转化为沉淀,简化操作
【解析】
海水中还含有大量的电解质,它们电离产生Cl-、Br -、I-、SO42-、Na+、Mg2+、Ca2+等,通过蒸发浓缩得到粗盐和卤水为母液,粗盐通过过滤除去泥沙得到初步提纯的粗盐,加入试剂除去杂质离子精制得到精盐,制成饱和溶液电解得到氢氧化钠、氯气、氢气,D具有杀菌消毒的作用说明为次氯酸钠,说明AB为氯气和氢氧化钠,C为氢气,母液中含有溴离子、镁离子等,加入氧化剂可氧化溴离子为溴单质,利用溴单质具有易挥发性用热空气吹出溴单质,得到粗溴;海带灼烧溶解得到含碘离子的水溶液,加入氧化剂氧化碘离子为碘单质,加入有机萃取剂萃取碘单质,分液后的有机层蒸馏得到碘单质,以此来解答。
(1)操作②是分离溶液和固体,用过滤操作,所以步骤②为过滤,反应⑤所用的气态氧化剂为氯气,在烧杯中利用导气管通入氯气;
(2)反应④是氯气和氢氧化钠反应生成次氯酸、氯化钠和水,化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,离子反应为Cl2+2OH-=Cl-+ClO-+H2O;
(3)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入氯化钡之后,碳酸钠会除去过量的氯化钡,过滤后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为becad;
(4)能用Ba(OH)2一种试剂替代步骤②中两种试剂,理由是Mg2+、SO42-均可转化为沉淀,简化操作。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案