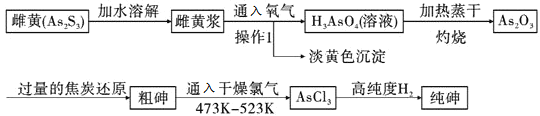
题目内容
【题目】由氢气和氧气反应生成1mol水蒸气放热241.8kJ,则反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH为( )
2H2O(g)的ΔH为( )
A.-483.6kJ·mol-1B.-241.8kJ·mol-1
C.-120.6kJ·mol-1D.+241.8kJ·mol-1
【答案】A
【解析】
方程中的热量和化学计量数对应成正比,2H2(g)+O2(g)![]() 2H2O(g)的△H为2mol氢气完全反应放出的热量。
2H2O(g)的△H为2mol氢气完全反应放出的热量。
氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+![]() O2(g)═H2O(g)△H=-241.8kJ/mol,方程中的热量和化学计量数对应成正比,则反应2H2(g)+O2(g)
O2(g)═H2O(g)△H=-241.8kJ/mol,方程中的热量和化学计量数对应成正比,则反应2H2(g)+O2(g)![]() 2H2O(g)的△H=(-241.8kJ/mol)×2=-483.6kJ/mol。
2H2O(g)的△H=(-241.8kJ/mol)×2=-483.6kJ/mol。
答案选A。

练习册系列答案
相关题目