题目内容
10.下述实验设计合理的( )| 选项 | 实验目的 | 实验设计 |
| A | 检测溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| B | 除去CO2中的HCl | 通过饱和的NaHCO3溶液,然后干燥 |
| C | 除去乙酸乙酯中的乙酸 | 加入足量的NaOH溶液,然后分液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.要检验溶液中是否含有亚铁离子,应该先滴加KSCN溶液再滴加氯水;
B.除杂时要除去杂质且不能引进新的杂质,不能除去需要的物质;
C.乙酸、乙酸乙酯都和NaOH溶液反应;
D.要证明H2CO3酸性比H2SiO3强,应该采用常温下强酸制取弱酸的方法.
解答 解:A.要检验溶液中是否含有亚铁离子,应该先滴加KSCN溶液再滴加氯水,排除三价铁离子的干扰,故A错误;
B.除杂时要除去杂质且不能引进新的杂质,不能除去需要的物质,HCl和饱和碳酸氢钠反应生成二氧化碳且不引进新的杂质,二氧化碳和饱和碳酸氢钠不反应,故B正确;
C.乙酸、乙酸乙酯都和NaOH溶液反应,应该用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,故C错误;
D.要证明H2CO3酸性比H2SiO3强,应该采用常温下强酸制取弱酸的方法,应该将二氧化碳通入硅酸钠溶液中观察是否产生白色沉淀,如果产生白色沉淀就说明H2CO3酸性比H2SiO3强,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、除杂、物质性质强弱判断等知识点,明确实验原理是解本题关键,注意离子检验要排除其它因素干扰、除杂不能引进新的杂质,易错选项是D,题目难度中等.

练习册系列答案
相关题目
20.在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量,已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的质量不可能是( )
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
1.元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
| A. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 短周期元素正化合价数值和其族序数相同 | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |
18.短周期元素X、Y、Z、W的原子序数依次增大,X-、Y2+与Ne原子电子层相同,Z是金属,W的最外层电子数是内层电子总数的一半,下列说法正确的是( )
| A. | 原子半径:r(X)>r(Y)>r(Z)>r(W) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Y的最高价氧化物对应的水化物碱性比Z的强 |
5.现有5种短周期元素X?Y?Z?Q?W,原子序数依次增大,在周期表中X原子的半径最小;X和W同主族;Y原子的核外电子总数是其次外层电子数的3倍,Q是地壳中含量最高的元素?下列说法不正确的是( )
| A. | 原子半径:Y<Q<W | |
| B. | ZX3可使紫色石蕊试液变蓝 | |
| C. | X?Z?Q可组成离子化合物或共价化合物 | |
| D. | X2Q2?Y2X6两种分子中含有的电子数?化学键种类都相同 |
15.下列有关有机化学的说法中不正确的是( )
| A. | 按系统命名法,化合物CH3CH(CH3)CH(CH3)CH2CH3名称2,3-二甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物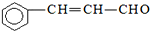 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. |  如图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
2.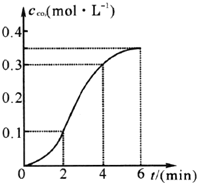 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1 mol/(L•min) |
6.铝箔在空气中加热,金属熔化而不滴落的原因是( )
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
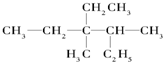 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷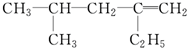
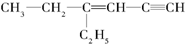 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个