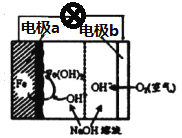
题目内容
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等),某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量盐酸后过滤出的滤渣中含有____________________,加入过量的NaOH溶液,过滤后的滤液中含有的溶质有_______________________(均填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,则每消耗0.1mol氧气有多少_____mol Fe(OH)2被氧化。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为___________________,沉淀A加热得到Al2O3的化学方程式为____________________。
(4)假设铝土矿中含杂质49%,则1吨铝土矿理论上可生产多少__________mol铝。
【答案】SiO2 NaOH NaAlO2 NaCl 0.4 AlO2-+CO2+2H2O===Al(OH)3↓+HCO3- 2Al(OH)3![]() Al2O3+3H2O 10000
Al2O3+3H2O 10000
【解析】
铝土矿的成分是Al2O3、Fe2O3、FeO、SiO2,其中Al2O3为两性氧化物,Fe2O3、FeO为碱性氧化物,SiO2为酸性氧化物,加入盐酸,发生Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,过滤,滤液中含有Al3+、Fe3+、Fe2+、H+、Cl-,加入过量的NaOH溶液,发生H++OH-=H2O、Al3++4OH-=AlO2-+2H2O、Fe3++3OH-=Fe(OH)3↓、Fe2++2OH-=Fe(OH)2↓,过滤,滤液2中含有离子是Na+、OH-、AlO2-、Cl-,通入过量CO2,发生OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,沉淀A为Al(OH)3,沉淀A受热分解为氧化铝和水,然后逐步分析;
(1)根据上述分析,加入过量的盐酸后,滤出的滤渣为SiO2,加入过量的NaOH溶液,过滤后的滤液中含有的溶质为NaCl、NaAlO2、NaOH;
(2)氢氧化亚铁被氧气氧化成氢氧化铁,根据得失电子数目守恒,0.1mol×2×2=n[Fe(OH)3]×1,即n[Fe(OH)3]=0.4mol;
(3)通入过量CO2,发生OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,因此生成氢氧化铝沉淀的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;氢氧化铝受热分解:2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(4)铝土矿中含杂质为49%,则含氧化铝为51%,根据铝元素守恒,因此有![]() =n(Al),解得n(Al)=10000mol。
=n(Al),解得n(Al)=10000mol。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案